Summary
Pícha, D. Lyme borreliosis
Lyme borreliosis is an infection that can affect several organ systems – skin, nervous system, joints, heart and eye. The clinical picture of Lyme borreliosis is highly variable. The basis of treatment is antimicrobial therapy, which is always necessary to apply, if infection is diagnosed and the patient hasn't been treated so far.
Lymeská borelióza (lymeská nemoc, LB) je infekce, která může postihovat několik orgánových soustav – kůži, nervovou soustavu, klouby, srdce a oko. Přestože je infekce jako etiopatogenetická jednotka známa teprve od počátku 80. let minulého století, některé její klinické projevy byly popsány již na konci 19. století. Jedná se například o zprávu dermatologa Buchwalda, který v roce 1883 publikoval popis chronické akrodermatitidy, která je nyní s infekcí jednoznačně spojena. Nejčastější kožní projev – migrující erytém (erythema migrans, EM, ECM) byl po přisátí klíštěte popsán nejprve Afzeliem v roce 1909 a v roce 1913 byla afekce pojmenována jako erythema chronicum migrans. Postižení nervové soustavy bylo zřejmě poprvé popsáno Garine a Bujadoux v roce 1922 u pacienta s meningopolyneuritidou a kožním erytémem. Později v roce 1941 byla Bannwarthem publikována skupina nemocných s meningitidou a mnohočetnou radikulitidou. Tento typ LB byl později označován jako Garin-Bujadoux-Bannwarthův syndrom.
Teprve mnohem později bylo zjištěno, že izolovaně popsaná onemocnění mají společnou příčinu. V roce 1975 začala skupina lékařů revmatologického oddělení na univerzitě Yale (USA) studovat sezónně se vyskytující artritidy. Byli na ně upozorněni obyvateli městečka Old Lyme (Connecticut). Steere a jeho kolegové zjistili, že se pravděpodobně jedná o infekční onemocnění přenášené klíšťaty. Ačkoliv řada postižených měla na kůži léze kompatibilní s EM, byla infekce pojmenována lymeská artritida, pro tehdy nejčastější klinický projev. Ve Spojených státech je totiž výskyt EM poměrně vzácný a tamní lékaři ho prakticky neznali. Brzy nato byla poprvé spirocheta vyvolávajíci infekci izolována z klíšťat Burgdorferem (1982) a onemocnění pojmenováno jako lymeská borelióza nebo lymeská nemoc.
Etiologie
Vyvolavatelem onemocnění je mikrob Borrelia burgdorferi sensu lato (B. b. s. l.; B. b.), který patří mezi spirochety. Do současné doby byly izolovány tři hlavní patogenní druhy: Borrelia garinii a B. afzelii, které jsou častější v Evropě, a B. burgdorferi sensu stricto, která je častějším původcem onemocnění na severoamerickém kontinentě. V přírodě byla izolována řada příbuzných druhů spirochet, které vzácně mohou také vyvolat lidská onemocnění (B. valaisiana, B. japonica, B. bissetii). B. b. je gramnegativní baktérie s bičíky na povrchu, které umožňují spirálovitý pohyb dovolující aktivní průnik jak lehce porušenou kůží, tak stěnou cévního endotelu či tkání. I když je kultivace borelií obtížná pro speciální růstové nároky a dlouhý generační čas, borelie jsou schopny dlouhodobě přežívat v kultivačních médiích (v nesrážlivé krvi v chladničce vydrží životaschopná několik týdnů). Přežívají také ve tkáních hostitelského organismu, a to zejména ve vazivu, kloubní synovii a nervové tkáni.
Epidemiologie
Borelióza je antropozoonózou, přičemž infekce se vyskytuje v celém mírném pásmu Evropy, Asie a Severní Ameriky. Spirochety kolují v přírodních rezervoárech zejména mezi drobnými hlodavci a velkými savci, ptáci se uplatňují v šíření infekce na velké vzdálenosti. Vektorem infekce jsou klíšťata (u nás Ixodes ricinus), přičemž pravděpodobnost přenosu infekce stoupá s délkou přisátí. Spirochety byly prokázány též u krev sajícího hmyzu (komáři), ale přenos touto cestou nebyl prokázán. Infekci lze přenést též kožními mikrotraumaty, například při vyjímání infikovaných klíšťat doma chovaným zvířatům.
Etiopatogeneze
Infekce u člověka začíná přenesením spirochet do kůže, kde se baktérie jednak množí a jednak se odtud dále šíří do celého organismu. Tento proces generalizace může být i velmi rychlý, protože už po několika dnech byly spirochety po experimentální infekci primátů nalezeny v CNS. Výsledkem intradermálního růstu je v typickém případě erytém – erythema migrans (EM), který přetrvává zpravidla několik týdnů. Později, zejména když je EM v blízkosti predilekčních míst, se v nich může objevit boreliový lymfocytom. Pozdní kožní manifestací, která je ovšem také vázána na predilekční lokalizaci, je chronická akrodermatitida (acrodermatitis chronica atroficans; ACA). Generalizované formy infekce vznikají šířením spirochet cestou krevní i lymfatickou, přičemž tento proces trvá několik týdnů až měsíců a bývá asymptomatický. Vzácně ho mohou provázet nespecifické chřipkovité příznaky. Infekce může být v kterékoliv fázi ukončena, a to buď za přispění antibiotické léčby, nebo spontánně.
Cílovými orgány při generalizaci jsou nejčastěji nervová soustava, klouby, myokard, oko a sekundárně opět kůže. Jakmile se spirochety v orgánech objeví, mohou se zde dále lokálně šířit aktivním pohybem a perzistovat zde měsíce i léta. Místa perzistence infekce mohou být zdrojem pro opětovnou sekundární generalizaci. Pozdní projevy boreliové infekce nejsou časté. Udává se, že podíl chronických infekcí nepřesahuje 1–2 % všech klinicky manifestních. K nejčastějším místům chronické infekce patří kůže, klouby a nervový systém, avšak průkaz borelií ve tkáních bývá v období pozdních projevů obtížný. Patogeneze chronické infekce není zcela objasněna. V zásadě se uplatňují dva patogenní mechanismy.
Prvním je lokální perzistence infekce, která – jak bylo výše uvedeno – nemusí být nijak masivní. Nedílnou součástí procesu jsou však také imunopatologické reakce, které vyúsťují jednak v doprovodnou orgánovou symptomatiku, jednak rezultují ve tkáňové postižení. Samotný mechanismus jeho vzniku je převážně hypotetický („toxické reakce“). V oblasti nervového systému se jedná například o pozdní encefalopatii. Lymeská artritida má také potenciál spustit imunopatologický kloubní zánět, který podle některých amerických údajů může postihnout až 10 % tamních nemocných s LB.
Imunitní reakce proti spirochetám je obecně relativně mírná, z čehož vyplývají časté inaparentní průběhy, avšak v porovnání k intenzitě je poměrně efektivní. Produkce protilátek začíná již ve 2.–4. týdnu po infekci syntézou IgM. Vrchol produkce nastává po 3–8 týdnech, po této době jejich hladina klesá mimo zcela ojedinělé případy, kdy jsou IgM protilátky prokazatelné měsíce i léta, aniž by to mělo vztah ke klinickému průběhu. IgG protilátky lze prokázat od 4.–8. týdne a přetrvávají zpravidla měsíce až několik let. Jejich hladina málo koreluje s klinickou aktivitou.
Od počátku 80. let je známo, že na eliminaci infekce se musí podílet podstatným způsobem mechanismy buněčné imunity, avšak přes rozsáhlé experimentální zkušenosti nejsou do současnosti jednoznačně definovány ani šíře klinicky využívány.
Klinické příznaky
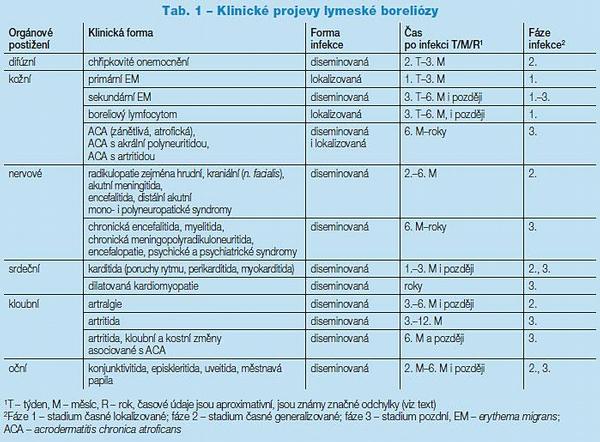
Klinický obraz LB je značně proměnlivý. Nejlehčí infekce probíhá bezpříznakově, nebo jen s minimálními a nespecifickými příznaky ve formě únavy nebo bolestí svalů či kloubů, paralelou může být i chřipkovitý syndrom. Podle rozvoje, resp. generalizace infekce se dělí na časné stadium, které probíhá zhruba 1–6 měsíců po infekci, a někdy se dále dělí na stadium časné lokalizované infekce (obvykle s trváním 1–3 měsíce) a stadium časné generalizace s latencí 3–6 měsíců. Tato perioda bývá někdy také označována 2. fází infekce. Pozdní nebo také chronické stadium infekce se, pokud je přítomno, vyvíjí po 6–12 měsících nebo i později (3. fáze infekce) (Tab. 1).
V dětském i adolescentním věku je zřejmá podstatná převaha časných forem onemocnění, chronické infekce se prakticky nevidí. Nejčastějšími projevy je EM a z nervových forem meningoradikuloneuritida, respektive neuritida lícního nervu. Akutní kožní infekce má v typickém případě formu erytému (erythema migrans – EM nebo erythema chronicum migrans – ECM). Na kůži je přítomno zarudnutí červené nebo lividní barvy, které se v typickém případě šíří centrifugálně, je jasně ohraničené. V centru postupně bledne, může se zde však objevit nová linie zarudnutí v případě, že dochází k novému šíření spirochet z místa původní inokulace. Celá afekce přetrvává většinou 2–4 týdny, poté bledne, někdy je provázena svěděním. Mizí spontánně nebo po antibiotické léčbě.
Z tohoto ložiska se spirochety dále šíří do organismu, dojde-li k zanesení infekce do jiné části kůže, mohou se objevit ložiska sekundárního EM, které mají také typickou morfologii. Pokud je EM vytvořeno, je patognomonické, avšak časná lokální reakce může být i zcela necharakteristická a malá. Jinou, většinou sekundární formou kožní infekce je boreliový lymfocytom (lymphadenosis benigna cutis). Jedná se kožní infiltraci nejčastěji červenofialového zbarvení s nejčastější lokalizací v místě ušního lalůčku, dvorce prsní bradavky, eventuálně skrota. Má typickou histologickou stavbu. Další, u dětí vzácnou formou kožní infekce je chronická akrodermatitida (acrodermatitis chronica atroficans, ACA), kdy je kůže tenká, červenofialově zbarvená. Afekce je typicky lokalizovaná na akrech rukou či nohou, zejména pokud v této lokalizaci došlo k přenesení infekce.
Časné stadium infekce vzácně provází zvýšená teplota nebo velmi lehká hepatopatie, lymfadenopatie či konjunktivitida. Generalizovaná infekce se zpravidla přihlásí nervovými příznaky, z nichž nejcharakterističtější je meningoradikulitida (Garin-Bujadoux-Bannwarthův syndrom). Postižení nervových kořenů se manifestuje bolestmi, parestéziemi a chabými parézami. Paralelou radikulitid je postižení hlavových nervů, a to jak izolovaně (hlavně n. VII, VI, III, VIII.), tak ve formě neuritis cranialis multiplex. Nejčastější formou je paréza n. VII, která je aktuální v dětském i dospělém věku. Meningitida se může objevit jako součást této formy, ale také jako doprovod encefalitidy nebo zcela samostatně. Meningoencefalitida časného stadia je většinou lehká, provázená bolestmi hlavy, případně nevýrazným centrálním neurologickým nálezem, což platí u dětí dvojnásob.
Podstatně méně často a většinou pouze u dospělých postihuje neuroborelióza během časného diseminovaného stadia také periferní nervový systém ve formě neuritid a polyneuritid; častěji je tato forma pozorována v pozdní fázi infekce. Neuritidy mohou být polytopní, které buď navazují na infekci míšních kořenů, nebo jsou následkem hematogenní generalizace. Existují také neuritidy topicky navazující na primární kožní ložisko infekce, odkud se šíří spirochety podél nervů centripetálně nebo postihují (někdy i značně rozsáhlou) oblast výskytu ECM nebo ACA. Periferní neuritidy mnohdy komplikují předchozí neuropatické postižení. Další relativně vzácnou, ale charakteristickou formou neuroboreliózy je infekce nervové tkáně v místech zasažených jinou paralelní patologií. Jde například o chronické diskogenní radikulopatie, kde zánět vyvolaný přítomností spirochet zhoršuje již dříve přítomné kompresivní obtíže.
Ostatní formy akutní boreliózy jsou vzácné. Jedná se jednak o myo-, resp. perikarditidu, v dětském věku naprosto výjimečnou. Postižení myokardu, které bylo opakovaně verifikováno i biopticky, je provázeno zejména převodními poruchami, arytmiemi. Oční formy jsou ještě vzácnější a v této době můžeme zastihnout kromě již uvedeného lehkou konjunktivitidu. Pozdní i chronickou fázi infekce provázejí afekce kožní, nervové a kloubní. Příznaky lze nalézt 6 měsíců až několik let po infekci. Bývají postiženi prakticky jen dospělí. Nervové formy pozdního stadia zahrnují jak centrální, tak periferní postižení. Nejčastějším centrálním postižením je meningoencefalitida či myelitida pozdního stadia.
Onemocnění má velmi pozvolný průběh, z dominujících příznaků jsou nejčastější psychické stesky (kognitivní poruchy, poruchy paměti, spánku, deprese, emoční labilita), velmi často bývá výrazná únava. Topický neurologický nález bývá jen lehký, zahrnuje vestibulární a cerebelární příznaky, zřídka hybné postižení. Celý průběh je často kolísavý, někdy s delšími obdobími latence. Pokud jsou příznaky přítomny bez objektivně prokazatelného nálezu včetně zobrazovacích metod, bývá takový typ postižení nazýván lymeskou encefalopatií pozdního stadia. Anglosaská nomenklatura více upřednostňuje tento pojem. U těžších forem s odpovídajícím klinickým a morfologickým nálezem na MR lze uvažovat o diagnóze chronické encefalitidy.
Postižení periferního nervového systému v pozdním stadiu infekce je opět především záležitostí pacientů ve vyšších věkových kategoriích; mohou zde být navíc přítomny jiné neuropatogenní faktory. Zánět má formu disperzní i ložiskovou. K typickým formám patří chronické (meningo)radikulitidy, mono- či polyneuritidy. Ne zcela běžným, ale charakteristickým postižením je zánět nervu v místě, kde byla (nebo ještě je) přítomna kožní forma, případně boreliová artritida či tendovaginitida. Odtud spirochety napadají příslušné nervy a mohou se šířit do proximálních částí, případě až do kořenů a míchy. Současná eventuálně přítomná diskopatie je potom dalším patogenním faktorem zhoršujícím celou situaci.
Kloubní forma boreliózy je doménou pozdního stadia, i když jsme opakovaně měli možnost pozorovat ojedinělé případy s akutní artritidou doprovázející déle probíhající kožní EM. Většinu pacientů tvoří dospělí, jasná artritida s otokem a výskytem borelií v synoviální tekutině však může postihnout i větší děti. Zánětem bývají zasaženy především velké klouby – kolena, hlezna, zápěstí, ramena. V Severní Americe je artritida častější, což se obyčejně vysvětluje dominujícím zastoupením patogenního kmene B. b. sensu stricto.
Chronická borelióza je méně přesně definované onemocnění, které přichází měsíce až léta po infekci spirochetami. V posledních letech se má za to, že za část „chronických“ případů mohou spíše reinfekce, neboť prodělané onemoc ní nemusí chránit před novou infekcí. Frekvence výskytu není přesně stanovena, odhaduje se na 1–3 % klinicky manifestních infekcí. V dětství se prakticky nevyskytují. Klinické projevy mohou mít formu jednotlivých orgánových postižení, jak byly dříve popsány, nejčastěji však mají následující podobu. Z nervových postižení je to spíše klinicky definovaná chronická encefalopatie s projevy kognitivního a paměťového deficitu, s poruchami spánkovými i emotivními. Jak již bylo uvedeno, podle naší vžité terminologie se podobné stavy nazývají encefalitidami. Jako chronickou encefalitidu, resp. encefalomyelitidu, lze však již označit případy, kde se kromě funkčních poruch objevují i klinicky prokazatelné nervové léze (motorické, mozečkové, extrapyramidové a jiné) a navíc je přítomen nález na MR.
V oblasti periferního nervového systému se infekce obvykle projevuje jako polyradikuloneuritida či neuritida. I po letech lze pozorovat onemocnění, kde se chronická neuroinfekce lokalizuje v místech původní infekce – tam, kde si pacient upamatuje na přisátí klíštěte nebo přetrvává v místech chronického postižení jiného orgánu (ACA, původní EM). V oblasti kožního systému je chronická infekce nejčastější ve formě ACA (většinou atrofická forma). Kloubní infekce může s remisemi přetrvávat léta, častější jsou však případy, kdy borelióza spouští imunopatologické onemocnění, které má tendenci probíhat dále samo. Přitom ale není vyloučena současná perzistence spirochet. Vzácné srdeční postižení může vyústit v dilatovanou kardiomyopatii. Současně přítomné chronické ischemické změny jsou vážnou diferenciálně diagnostickou komplikací.
Lymeská borelióza v těhotenství je dosud neuzavřený problém. Pro příbuznost B. burgdorferi a Treponema pallidum se od počátku 80. let předpokládala možnost transplacentárního přenosu infekce i intrauterinního postižení plodu. V ojedinělých případech byla spirocheta izolována u malformovaných plodů, kauzální souvislost mezi infekcí a postižením však nebyla dosud prokázána v žádném případě. Pokud se pomýšlí na diagnózu LB během těhotenství, je nutno vždy zvažovat předpokládaný profit terapie. Avšak právě pro biologické vlastnosti spirochet a jejich potenciální možnost transplacentárního přestupu je nutno klinicky manifestní případy léčit.
Postboreliový syndrom je klinická jednotka, a proto je nejasně vymezena. Jedná se o soubor příznaků, jako jsou únava, emotivní labilita, bolesti hlavy, bolesti kloubů a svalů, spánkové poruchy a další málo specifické příznaky. Následují jak po prodělané a adekvátně léčené borelióze, tak po neléčeném či nerozpoznaném onemocnění. Testy na perzistující infekci musí být negativní (DNA, imunoelektronová mikroskopie). Opakovaná antibiotická léčba obvykle nepřináší efekt, terapie je symptomatická. Případy jsou relativně časté, ty těžší lze jen těžko odlišit od chronické infekce.
Diagnostika
Diagnostika boreliózy je založena především na klinických příznacích onemocnění. Důležitou součástí anamnézy je údaj o přisátí klíštěte, který má velkou váhu v případě, že se v místě přisátí objevilo typické EM. Údaj je však zapotřebí hodnotit opatrně, protože zejména déle přisáté klíště vyvolává nespecifickou lokální zánětlivou reakci, která nemá nic společného s infekcí spirochetami. V takovém případě je zarudnutí omezeno na bezprostřední okolí invaze. Místo může být postiženo i jinou, například stafylokokovou infekcí. Dále nutno vzít v úvahu, že zdaleka ne všichni pacienti s LB mají v anamnéze údaj přisátí klíštěte – u pacientů s neuroboreliózou uvádí v našich podmínkách klíště asi třetina nemocných. Z klinických projevů má patognomonický význam EM a ACA, u nervových příznaků je nutno diagnózu zvažovat především při výskytu radikulárních bolestí a paréz (parézy lícního nervu). LB je u nás častým onemocněním, proto je třeba na diagnózu pomýšlet a cíleně provádět laboratorní vyšetření.
Diagnosticky jsou významné zejména následující údaje:
• přisátí klíštěte v endemické oblasti,
• kožní příznaky (EM, histologicky verifikovaný kožní lymfocytom nebo acrodermatitis chronica atroficans),
• průkaz specifických protilátek v tělních tekutinách,
• průkaz B. burgdorferi v organismu (PCR, mikroskopie, kultivace),
• některý z dalších projevů, u nichž byla vyloučena jiná příčina (lymfocytární meningitida, kraniální neuropatie, bolestivá radikulopatie, encefalomyelitida, encefalopatie, periferní neuropatie),
• artritida, zejména monoartritida, nebo artralgie, u kterých byla vyloučena jiná příčina.
Laboratorní diagnostika LB není vzhledem ke klinickým potřebám optimálně definována. Hlavním prostředkem je průkaz specifických protilátek většinou technikou ELISA, touto cestou lze prokazovat IgM i IgG protilátky v séru, mozkomíšním moku i kloubním punktátu. Metoda poskytuje ze všech ostatních dostupných prostředků prakticky nejvyšší senzitivitu, má však některá úskalí. Tvorba IgM protilátek je spojena s časným obdobím infekce – přibližně do 2–3 měsíců, potom jejich hladina klesá, senzitivita většinou nepřesahuje 30–50 %. Vzácně z neznámých důvodů přetrvává měsíce i léta, aniž by tato skutečnost měla vztah ke klinickému průběhu. Tvorba IgG protilátek začíná přibližně po 4–6 týdnech a poté jejich hladina stoupá.
V období generalizované infekce jsou již IgG protilátky prokazatelné, přičemž senzitivita v této fázi dosahuje 80–90 % a dále stoupá v pozdní, respektive chronické fázi. Specifita sérodiagnostiky je podstatně nižší. Tento parametr ovlivňuje minimálně 10–20 % séroprevalence a potom také skutečnost, že IgG protilátky přetrvávají po zvládnutí infekce 1–3 roky. Závažným nedostatkem protilátkové diagnostiky jsou falešně pozitivní reakce způsobené především zkříženě reagujícími protilátkami. Z toho důvodu je již dnes prakticky běžně zavedena dvojstupňová diagnostika, která spočívá v zařazení Western-blottingu (WB) jako konfirmující techniky. Vyšetření WB se provádí při pozitivitě prvního sérologického testu, a dále tam, kde jeho výsledek nekoreluje s klinickým obrazem. Vždy existovaly ojedinělé séronegativní případy.
Přímý průkaz infekce je možný zejména pomocí specifické DNA (PCR). Technika nemá dosud charakter plošného vyšetřování, není standardizována a její citlivost se značně liší podle metodiky i použité tělní tekutiny (je maximálně 30–60 %). Mikroskopické vyšetření bývá omezeno na specializovaná pracoviště, zejména za použití elektronové mikroskopie. Je drahé a má nízkou citlivost, specifita je však vysoká, hlavně pokud jsou současně použity monoklonální protilátky. Pro nervové a kloubní formy je důležitý vysoce specifický lokální průkaz specifických protilátek. V mozkomíšním moku jsou prokazovány buď jednoduchou ELISA metodou, nebo semikvantitativní technikou pomocí stanovení protilátkového indexu mok/sérum. Dále lze u kloubních forem prokazovat protilátky v synoviání tekutině.
Terapie
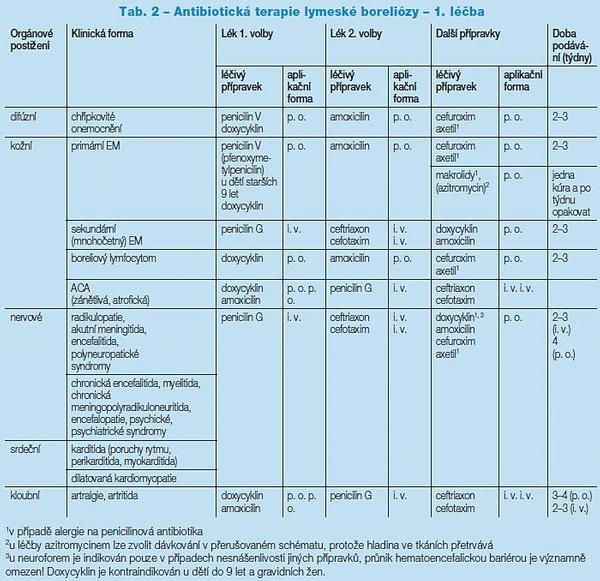
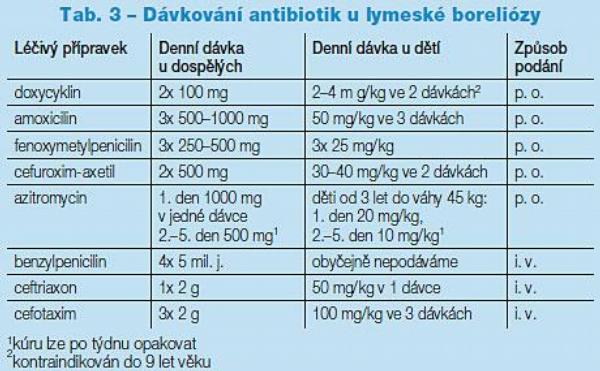
Léčba LB má dva hlavní cíle – eliminovat mikroba a zbavit pacienta obtíží. Základem je léčba antimikrobiální, kterou je zapotřebí aplikovat vždy, je-li infekce diagnostikována a pacient dosud nebyl léčen. Hlavní preparáty jsou uvedeny v Tab. 2, 3.
Antibiotická terapie je založena především na empirických a teoretických údajích, neboť velké dvojitě slepé studie nebyly provedeny. Zdá se, že konkrétní antibiotikum i léčebný režim má na výsledný efekt jen malý vliv, pokud je vyhověno základním požadavkům. Nejdůležitější je podat vhodný přípravek v dostatečné dávce a délce. Léčebná schémata se v posledních 15 letech prakticky nemění. Pro perorální léčbu dospělých je na prvním místě doxycyklin, u dětí do 9 let a gravidních žen hlavně penicilinová antibiotika, případě spiramycin. Cefuroxim-axetil lze podat u alergie na peniciliny, resp. tetracykliny, podobně jako makrolidy (azitromycin, klaritromycin). Posledně jmenované mají omezenou účinnost u nervových forem pro minimální průnik do CNS. Ve 2. stadiu se podávají především cefalosporiny 3. generace a benzylpenicilin pro dostatečný průnik do nervové tkáně.
Délka podávání antibiotik je při první léčebné kúře převážně 2–3 týdny u časných kožních forem. U nervových forem při intravenózní léčbě je léčba většinou 3týdenní a obyčejně se neprodlužuje. Totéž se dá říci i o dalších formách postižení. Nikdy nebylo jednoznačně prokázáno, že léčba delší než 4 týdny má větší klinický efekt. Po podání základní léčby odeznívají některé klinické příznaky zvolna a na výsledný efekt léčby se čeká 3–6 měsíců. Po tuto dobu se obyčejně nepodávají další antibiotika, pokud k tomu není závažný důvod. Opakování léčby při nespecifických potížích, například únavnosti, bolestech kloubů či bolestech hlavy, se nedoporučuje, protože nebyl zjištěn signifikantní rozdíl v ústupu potíží. Indikace opakované léčby bývají nejednoznačné, vesměs empirické. Lze o ní uvažovat, má-li pacient jasné klinické obtíže. Z laboratorních testů podporuje opakovanou léčbu průkaz lokálně produkovaných protilátek (mozkomíšní mok, synovie), případně průkaz specifické DNA, jestliže uplynulo od předchozího podání antibiotik více než 6 měsíců. Samotná pozitivita sérových specifických protilátek není důvodem k opakování antibiotické léčby!
Léčba lymeské boreliózy je komplexní a je realizována odborníky podle příslušných klinických projevů. Pacient má být informován o postupném léčebném efektu a dále sledován po dobu 1–2 let. Významnou součástí terapie je snaha o minimalizaci doprovodných obtíží, jako jsou četné psychické stesky, spánkové poruchy, kloubní bolesti apod. Vhodně prováděná psychoterapie je mnohdy velmi výhodná a pomůže k překlenutí období postupného ústupu obtíží. Tento komplexní přístup pomáhá redukovat opakované vyšetřování a léčení u pacientů, kde by většinou nepřineslo žádný efekt.
Onemocnění má většinou dobrou prognózu, specifická léčba je účinná, navíc nemoc ustupuje i spontánně. Jedinou možností prevence je minimalizace kontaktu s klíšťaty, neboť očkovací látka není v současné době na trhu. Používáme kontroly po návratu z přírody, přiléhavý oděv, repelenty.
O autorovi: Doc. MUDr. Dušan Pícha, CSc. Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice Na Bulovce, I. infekční klinika
e-mail: dusan.picha@fnb.cz
