Doc. MUDr. Zdeněk Holub, CSc.
Nemocnice Kladno, Gynekologicko-porodnické oddělení, Endoskopické výukové centrum,
Spolupracující pracoviště 1. LF UK v Praze
Klíčová slova
epidemiologie • prognostické faktory • diagnóza • staging • grading • léčebné metody a výsledky • adjuvantní léčba
Incidence maligních nádorů děložního těla se blíží ve vyspělých zemích počtu 30 na 100 tisíc žen a mezi gynekologickými nádorovými onemocněními jsou na prvním místě. Ve více než 95 procentech se jedná o karcinom endometria (CE) různých histologických subtypů, ve zbývajících procentech jde o některou z forem sarkomů.
Etiologie
Exogenní faktory
Exogenně podávané estrogeny a látky jim podobné mohou, pokud jsou aplikovány bez gestagenní složky po řadu let, vyvolat maligní transformaci endometria. Největší účinek na proliferaci endometria prokazuje estradiol. Zvýšené riziko vzniku karcinomu endometria bylo pozorováno u žen léčených pro karcinom prsu pomocí tamoxifenu. Bylo prokázáno zvýšené riziko CE v závislosti na dávce neoponovaných estrogenů. Statisticky významná je větší dávka než 0,3 mg neoponovaných, konjugovaných estrogenů (Cushing,1998). V současné době není žádný doklad o úloze lidského papillomaviru v kancerogenezi endometriálního karcinomu.
Výživa. Obezita, která je často spojena s diabetem a hypertenzí, je typickým epidemiologickým rysem pacientek s CE. V tukových tkáních dochází ke zvýšené konverzi androstendionu v estron. Konverze cirkulujícího estronu v estradiol dále zvýší množství biologicky aktivního estrogenu. Vlastní etiopatogenický vliv obezity na vznik karcinomu endometria není ještě zcela jasný. Většina dosavadních studií se shoduje na tom, že distribuce tuku je determinována geneticky a že centrální typ obezity je spojen s hyperinzulinémií. V současné době se předpokládají dva možné mechanismy rizikového působení hyperinzulinémie: v prvé řadě by mohlo jít o přímý vliv na mitotické děje ve tkáních endometria působením zvýšené bioaktivity inzulínových růstových faktorů (insulin-like growth factor I a II) a za druhé by mohlo docházet nepřímým způsobem k odkrytí genetických abnormit v ovariální steroidogenezi.
U žen s CE často nacházíme v anamnéze doklady o ovariální dysfunkci s následky v podobě ovariálních poruch, luteální insuficience, anovulačních cyklů a snížené plodnosti. Hyperestrogenismus endogenního původu nalézáme často v souvislosti se zvýšenou produkcí estrogenů u žen s polycystickými ovarii, nádory z buněk granulózy nebo theky. Prodloužený a stálý vliv estrogenů zvyšuje riziko vývoje karcinomu děložního těla. Estrogeny ale samy o sobě nejsou primárními kancerogeny. V normálních buňkách je počet estrogenových receptorů regulován estrogeny. Synkarcinogenní působení zvýšeného množství estradiolu je následováno blokádou a sníženou tvorbou estrogenových receptorů. V konečném důsledku dochází k nadměrné proliferaci a maligní transformaci hyperplazie endometria.
Progestiny ovlivňují počet receptorů, redukují DNA syntézu a modulují účinek estrogenů na endometrium.
Epidemiologie
Karcinom endometria se nejčastěji vyskytuje po menopauze v období mezi 50.–65. rokem života ženy. Pouze asi 5 % žen onemocní před 40. rokem. U černé rasy je zvýšená incidence CE a posun vrcholu incidence asi o 10 let. V České republice je ročně diagnostikováno asi 1500 nových onemocnění karcinomem děložního těla, který se tak stává nejčastějším nádorem z oblasti genitálního traktu. Přes zvyšující se incidenci CE ve vyspělých zemích dochází ale k poklesu mortality. V letech 1950–1975 v důsledku zlepšené léčebné péče došlo k poklesu mortality asi o 10 %. Pětiletý interval přežití se pohybuje kolem 80 %. Nebyla prokázána teorie dvou karcinomů s rozdílným biologickým chováním a intervalem přežití. Někteří autoři (Gussberg,1988) se ale domnívají, že vysoce diferenciované hormonálně dependentní karcinomy se chovají více benigně, v porovnání s karcinomy vzniklými následkem exogenních hormonálních vlivů. Z pohledu rozdílné patogeneze lze uvažovat o obecně více rozšířeném mechanismu vzniku nádoru z předchozího hyperplasticky změněného endometria anebo méně často o vývoji karcinomu de novo. Druhý a méně častý typ patogeneze se uplatňuje například u granulózových nádorů ovaria a thekomů. Relativní riziko endometriálního karcinomu je zvýšeno u žen, které v minulosti užívaly estrogenní substituční léčbu (ERT). Dlouhodobá léčba a pravděpodobně i vyšší dávka toto riziko zvyšují. Přidání progestagenu k ERT na dobu 10 (a více) dnů každý měsíc snižuje riziko EC. Zatím není jasné, zda je toto riziko sníženo až na úroveň srovnatelnou s ženami, které HRT nikdy neužívaly.
Morfogeneze a histopatologie
Následky zvýšené proliferace endometria v podobě hyperplazie mohou být odloučeny v průběhu menstruace. U pacientek s dysfunkčním krvácením může být odlučování neúplné a zbytky neodloučeného hyperplastického endometria jsou tak vystaveny další estrogenní stimulaci. Velmi vzácně vede další apozice těchto autonomně proliferujících žlázových ostrůvků k maligní transformaci celého endometria. Tento mechanismus bývá spíše typický pro vývoj polypu endometria.
Hyperplazie endometria
(prekurzory, raná stadia)
Endometriální hyperplazie je patologický stav, který je obvykle spojován s abnormálním děložním krvácením. Hyperplazie endometria vzniká následkem estrogenní stimulace bez cyklické transformace progesteronem. Glandulární a glandulárně-cystická hyperplazie pravděpodobně představují nejranější fáze směrem k vývoji karcinomu endometria. Riziko vývoje ložiskové adenomatózní hyperplazie stoupá v závislosti na délce trvání glandulární hyperplazie endometria. Ložiska adenomatózní hyperplazie se postupně spojují a mohou úplně nahradit glandulárně-cystickou hyperplazii. Adenomatózní hyperplazie může být fokální nebo difúzní. Stupeň poruchy uspořádání žláz, buněčná atypie, vztah ke stromatu a myometriu jsou rozhodujícím kritériem pro hodnocení závažnosti a maligního potenciálu adenomatózní hyperplazie. Sherman (1979, USA) ve své studii hodnotící maligní potenciál žen s hyperplazií endometria rozlišuje cystickou hyperplazii, adenomatózní hyperplazii, atypickou hyperplazii a carcinoma in situ a potvrzuje 22% riziko u mírných forem hyperplazie a 58% riziko u carcinoma in situ. Pojem carcinoma in situ nenašel v klinické praxi uplatnění. Vyšší stupně hyperplazie jsou spojeny s mírným nebo středním stupněm anizonukleózy. U těžké formy adenomatózní hyperplazie (grade 3) jsou shlukující se žlázky v postavení „back to back“. Z řady klasifikací bylo v některých evropských zemích používáno Burghardtovo dělení na hyperplazii prostou a adenomatózní (I–III) v závislosti na hodnocení poměru mezi zmnožením žlázek a stromatu. Tento poměr bývá u adenomatózní hyperplazie zvýšen ve prospěch žlázek. Dělení do jednotlivých stupňů I–III je závislé na hodnocení stupně strukturálních a cytologických abnormit.
V České republice byly v 70.–80. letech poruchy proliferace endometria nejčastěji klasifikovány jako glandulárně-cystická hyperplazie (prekanceróza endometria v širším slova smyslu) a atypická hyperplazie endometria (prekanceróza v užším slova smyslu). Kurman a spol. (USA,1985) rozlišují na endometriu změny na bázi buněčné (s atypií nebo bez atypie) a architekturální (simplexní nebo komplexní poruchy žlázového uspořádání) charakteristiky.
Tato klasifikace je v současné době považována za oficiální klasifikaci WHO. Endometrial Collaborative Group (ECG) publikovala řadu recentních materiálů, které se zabývají základní myšlenkou, jak učinit klasifikaci hyperplazií endometria jednodušší a praktickou. Diskutuje se o návrhu (Muttler, 2000) na rozlišení endometriální hyperplazie (EH), endometriální intraepiteliální neoplazie (EIN) a adenokarcinomu. EIN by poté představovala jedinou prekancerózní lézi endometria. Nejvyšší riziko přisuzují ženám s komplexní atypickou hyperplazii, kde asi v jedné třetině došlo ve sledovaném souboru 35 žen k progresi v karcinom endometria v průběhu 1–25 let.
Byl též popsán výskyt CE u žen po předchozí hysteroskopické ablaci hyperplastického endometria. Hyperplazie endometria je relativní kontraindikací k HSK ablaci endometria (Gimpleson,1988).
Přehled a porovnání některých klasifikací hyperplazií endometria přináší Tab. 1.
Karcinom endometria
Podobně jako u jeho prekurzorů je karcinom endometria (CE) obvykle složen z maligních žlázových komponent a z nemaligního vaskulárního stromatu. Karcinomy jsou vzácně jen čistě žlázové (s přítomností nebo chyběním epiteliální metaplazie), nebo častěji obsahují i skvamózní epiteliální složky (smíšený typ).
Grading
Již ve dvacátých letech tohoto století byl znám prognostický význam stupně diferenciace CE. Podle upravené klasifikace FIGO (1976) jsou rozlišovány tři stupně diferenciace (gradingu) karcinomu endometria:
G1 – vysoce diferencovaný adenokarcinom,
G2 – středně diferencovaný adenokarcinom s místy solidními okrsky,
G3 – převážně solidní nebo zcela nediferencovaný karcinom.
Většina případů EC je ve skupině G1 a G2, pouze asi v 15–20 % je grading karcinomu řazen do třetího stupně. Histologický grading má svou paralelu v hloubce myometriální invaze a v četnosti lymfatických metastáz. Nicméně i malé ložisko dobře diferencovaného CE může vést k metastázám a smrti pacientky.
Histologické subtypy
Zastoupení a přítomnost jednotlivých mikroskopických struktur v karcinomu endometria má zcela zásadní prognostický význam. Lze rozlišit dvě vedoucí kritéria: poruchu architektury a stratifikace žlázek a stromatu (shlukování „back to back“) a individuální buněčné změny (různý stupeň zralosti a dediferenciace buněk s jadernou a mitotickou abnormitou či anaplazií). Je řada histologických klasifikací CE, ale nejčastěji bývá v klinických studiích používána klasifikace Christophersona (1982), která je v přehledu uvedena v Tab. 2.
V diferenciální diagnóze CE mohou někdy nastat obtíže při rozlišování atypické hyperplazie endometria (adenomatózní hyper plazie endometria G3) a dobře diferencovaného karcinomu endometria. Hertigem (1949) uvedený pojem „adenocarcinoma in situ“ nedoznal širšího uznání pro obtíže v klinické diagnostice. Společný výskyt karcinomu a hyperplazie endometria je popisován asi ve 40 % případů, zejména u mladších žen a lépe diferencovaných typů (Gucer, 1998)
Prognostické faktory
1. Klinické stadium podle definice FIGO
2. Rozsah infiltrace myometria
3. Mikroskopický grading
4. Šíření do hrdla
5. Estrogen-dependence
6. Histologický subtyp
7. Invaze do lymfatických cév
8. Invaze do krevních cév
9. Stav hormonálních receptorů
10. p53 vysoké hodnoty
11. HER-2/neu (vysoké hodnoty onkogenů jsou nepříznivé)
12. EGFR (epidermální růstový faktor)
13. DNA ploidita
14. Buněčná proliferace (tzv. S fáze frakce a vysoký mitotický index), výrazná známka predikce rizika a agresivity
Způsoby šíření karcinomu endometria
Místní šíření
Děložní fundus je typickým místem, kde bývá nejčastěji lokalizován CE. Většina karcinomů endometria bývá poměrně dlouhou dobu limitována umístěním jen v oblasti děložní sliznice. Obecným morfogenetickým rysem je multicentrický růst ložisek CE o různém stupni dediferenciace. Tato vlastnost také bývá příčinou chybně stanoveného předoperačního gradingu na základě předchozí kyretáže. Dobře diferencované karcinomy prokazují obvykle exofytický růst směrem do dutiny děložní, kterou mohou zcela vyplnit. Pyometra je typickým následkem obstrukce cervikálního kanálu. Méně diferencované karcinomy mají tendenci k šíření přímo do myometria a lymfatických prostor směrem k subserózní vrstvě dělohy. Šíření nádorového procesu do děložního hrdla (stage II) probíhá nejčastěji cestou lymfatických sítí umístěných pod cervikálními žlázami.
Lymfatické šíření
Lymfatické šíření hraje u karcinomu endometria důležitější roli než hematogenní rozsev. Jak již bylo zmíněno v předchozím odstavci, lymfatické prostory v myometriu jsou drénovány do subserózních mízních sítí. Z oblasti děložního fundu probíhá sběr lymfy směrem do ovariálního ligamenta a cestou ovariálních plexů do externích ilických a paraaortálních mízních uzlin, ale také cestou oblého vazu do ingvinálních a femorálních uzlin. Ze střední a distální části dělohy probíhá drenáž lymfy prostorem plica lata do pánevních uzlin. Nicméně zůstává nejasné, jak probíhá drenáž v oblasti parametrií, kde nebylo opakovaně prokázáno nádorové postižení u pacientek se stadiem II. Nárůst postižení lymfatických uzlin je v přímé souvislosti se stupněm infiltrace myometria a vyšším stupněm gradingu.
Vzdálené metastázy
Rozšíření nádoru do pochvy se objevuje u 7,3 % pacientek, může být jak lymfatické, tak hematogenní, a je v každém případě nepříznivým prognostickým faktorem. V oblasti poševní jizvy se mohou objevit pozdní metastázy po předchozí primární léčbě. Karcinom endometria se může též šířit přímo z myometria nebo lumen vejcovodů a implantovat se na pobřišnici. Více než polovina žen s intraperitoneálním rozsevem má též pozitivní retroperitoneální uzliny a v 23 % pozitivní paraaortální uzliny (Creasman, 1987). Nitrobřišní rozsev je častěji spojen s následujícím histologickými subtypy: papilární, clear-cell, adenoskvamózní a špatně diferencovaný karcinom endometria.
Symptomatologie
Nejčastějším projevem maligních nádorů děložního těla je krvácení v období postmenopauzy, které se objevuje asi v 80 % všech případů. V zásadě každá pacientka s postmenopauzálním krvácením musí být histologicky vyšetřena.
Diagnóza
Včasná diagnóza
Byla vyvinuta celá řada screeningových systémů k včasné detekci karcinomu endometria u asymptomatických žen, z nichž žádný dosud nesplnil všechny předpoklady.
Cytologie a histologie
K získání materiálu z děložní dutiny bylo vyvinuto více instrumentů. Ať již se jedná o instrumenty charakteru kartáčků, či aspiračních kanyl, všechny jsou limitovány tím, že asi v 10 % nezajistí odběr reprezentativního materiálu u malých nádorových ložisek nebo karcinomů uložených v hlubší vrstvě endometria.
Ultrasonografie
Princip ultrasonografické diagnostiky patologií endometria vychází z poznatku o tom, že výška postmenopauzálního endometria by neměla přesahovat 5 mm. Nejsou ještě zcela vypracována sonomorfologická kritéria k odlišení benigních a maligních změn na endometriu. Větší diagnostický přínos než abdominální ultrasonografie prokazuje transvaginální ultrasonografie (TSV). Nádorová infiltrace myometria může být diagnostikována s přesností asi 80 %. Nejdůležitějším ultrasonografickým kritériem zůstává přerušení hypoechogenní linie mezi endometriem a myometriem, protože ostatní kritéria prokazující mukometru či pyometru jsou přítomna méně než v přibližně 20 % a nelze je považovat za včasná. Diagnostický problém představují ženy s HRT, kde je výška endometria přirozeně vyšší úměrně hormonální substituci. Za arbitrážně bezpečnou výšku sliznice u žen s hormonální substitucí se považuje výška pod 7 mm, ale v této otázce není všeobecný souhlas. Je nutné zdůraznit, že vaginální ultrasonografie nenahrazuje biopsii endometria zejména tam, kde se objevuje abnormální krvácení.
Hysteroskopie
Cílený odběr materiálu z dutiny děložní při nejméně dvacetinásobném zvětšení zlepšuje diagnostické možnosti zejména odlišením některých nitroděložních patologií (septum, submukózní myom, synechie), a snižuje tak chyby slepých odběrů. Naděje vkládané do této metody se však zcela nenaplnily a zůstává otevřená otázka rizika zavlečení nádorových buněk do dutiny břišní při aplikaci distenčního média.
Frakcionovaná kyretáž – GOLD standard
U všech symptomatických pacientek s metroragií v období perimenopauzy nebo v obdobím pozdějším by měla být provedena frakcionovaná dilatace a kyretáž dutiny děložní buď pod kontrolou hysteroskopu, nebo samostatně.
Management klinického karcinomu endometria
Klinické vyhodnocení prognostických faktorů a současných diagnostických a léčebných postupů dává reálný podklad k návrhu managementu CE.
Předoperační hodnocení
Hysteroskopie (HSK)
Naděje vkládané do hysteroskopického vyšetření před operační léčbou s cílem upřesnit rozsah nádorového onemocnění se nesplnily. Nebyla prokázána korelace mezi HSK a hloubkou myometriální invaze. Hysteroskopie z tohoto pohledu má svůj význam pouze v upřesnění lokalizace a diagnostiky nejasných patologických procesů v děložní dutině a v některých případech šíření nádoru do děložního hrdla.
Transvaginální ultrasonografie (TSV)
Jde o neinvazívní předoperační metodu vhodnou k měření myometriální infiltrace. Při invazi do myometria větší než 50 % dosahuje senzitivita až 93 %. Diagnostická přesnost není ovlivněna předchozí kyretáží.
Magnetická rezonance (MRI)
Výhodou MRI ve srovnání s ultrasonografií je lepší kontrast měkkých tkání a možnost snímání obrazu v každé zvažované rovině. Predikční přesnost se pohybuje v intervalu 80–90 % a je ve srovnání s TSV vyšší. MRI dále umožňuje lepší hodnocení mízních uzlin a ovarií. Kombinace MRI a intrauterinní kontrastní ultrasonografie dosahuje více než 85 % predikce přesnosti v posouzení myometriální invaze (Tsuda,1997) a zlepšuje zejména diagnostiku superficiální invaze.
Computerová tomografie (CT)
Doré a spol. (1987) uvádějí celkovou přesnost CT v 76 % a pro účel posouzení myometriální infiltrace až 83 %. Nevýhodou je horizontální limitace vyšetřovaných rovin.
Staging
Klasifikační schémata karcinomu endometria prošla celou řadou změn. První klasifikace Heymanova z roku 1925 rozlišovala pouze pacientky vhodné k operaci či neoperabilní.
Operační staging
V polovině 90. let bylo prokázáno, že určení stadia choroby na základě pouhého klinického vyšetření je nedostatečné (Cowles, 1985). Podle studií Creasmana a spol. byla u stadia I prokázána 15–20% chyba. Nejdůležitější prognostické známky, jako jsou hloubka myoinvaze, postižení uzlin a mimoděložní šíření, mohou být nejlépe stanoveny pomocí chirurgicko-patologických důkazů. Na základě těchto kritérií byla založena klasifikace FIGO (1988) v podobě, kterou přináší Tab. 3.
Speciální diagnostika
Nádorové markery
Znalosti o tumorových markerech karcinomu endometria jsou ještě limitované. U více než poloviny žen s CE je zvýšena sérová hladina CA 125, CA 19-9 a fetoproteinu. Naproti tomu hladiny CA 15-3, CEA, LDH a pyrofosforylázy kyseliny inosinové jsou nízké. Statistická významnost zvýšení senzitivity a specificity kombinace CA 125, CA 19-9 a fetoproteinu nebyla potvrzena. V klinické praxi je nejvíce využíván CA 125 v předoperační diagnostice a posléze v monitorování terapie.
Steroidní receptory
Stanovení hodnot steroidních receptorů u karcinomu endometria je komplikováno skutečností, že normální epiteliální buňky a stroma obsahují hladiny receptorů (estrogenový receptor – ER, progesteronový receptor – PR) v podobné výši jako u receptor-pozitivních karcinomů. U pokročilých CE je PR pozitivita dobrým indikátorem úspěšnosti hormonální terapie.
Stanovení DNA ploidity
Flow-cytometrická analýza je objektivní metodou, která stanoví DNA obsah v maligních buňkách a přispívá ke zjištění biologické agresivity malignomu. Byl prokázán vztah mezi vysokou incidencí prognosticky nepříznivých faktorů a vysokou incidencí aneuploidity.
Terapeutické metody a výsledky
Chirurgická terapie
V návaznosti na výše uvedenou klasifikaci FIGO je chirurgická léčba základní diagnostickou a terapeutickou strategií u všech operabilních pacientek. Spektrum operací je široké a odráží dlouhou vývojovou řadu názorů. Provedení hysterektomie s oboustranným odstraněním adnex a peritoneální laváží je základním výkonem. Otázky spojené s regionální lymfadenektomií jsou v některých ohledech kontroverzní a není zde jednotný názor. Nicméně většina pracovišť v západní Evropě a USA řadí lymfadenektomii do základního operačního protokolu u pacientek se zvýšeným rizikem. Dokonalý chirurgický staging nelze bez informace o stavu mízních uzlin provést. Komentář k jednotlivým operačním přístupům vychází z doporučení kongresu Evropské gynekologicko-onkologické společnosti (XV. Congress of ESGO, Budapešť,1999).
Abdominální přístup. Abdominální hysterektomie provedená extrafasciální technikou zůstává zatím nejrozšířenějším typem operace u pacientek s karcinomem endometria. K uzávěru děložního hrdla a zábraně expulze nádorových buněk byla použita řada operačních technik (sutura, klipy). Představa o preventivním významu těchto metod na výskyt recidiv v poševní sutuře nebo pochvě nebyla prokázána. Kontraverzní a otevřenou otázkou zůstává i význam peritoneální cytologie. U žen s pozitivní cytologií existuje souhlasné stanovisko k úpravě léčebného protokolu.
Vaginální přístup. Rozšíření endoskopických operací o laparo-vaginální přístup znovu otevřelo prostor pro racionální diskusi o možné roli vaginální hysterektomie v onkochirurgii. Karcinom děložního těla je modalitou, která v určitých situacích (vysoký věk, přítomnost descenzu, vysoké operační riziko, nízký potenciál malignity tumoru) nabízí řešení pomocí vaginálního přístupu. V řadě literárních prací je dokládáno srovnatelné přežívání pětiletého intervalu (Blass, Massi,1991).
Nevýhoda poševního přístupu spočívá v nemožnosti dokonalé explorace břišní dutiny a odstranění adnex ve všech případech.
Laparoskopický přístup. Laparoskopický asistovaný chirurgický staging splňuje všechny předpoklady k dokonalé exploraci dutiny břišní, přístupu k regionálním pánevním a paraortálním lymfatickým uzlinám, odstranění adnex a dělohy poševní cestou (Obr. 1, 2, 3). Byla prokázána lepší rekonvalescence žen po laparoskopicky provedené hysterektomii (Holub, 1998). K dispozici ještě nejsou závěry dlouhodobé studie Gynecology Oncology Group, které by měly odpovědět na řadu otázek. Bylo popsáno několik případů výskytu metastáz karcinomu endometria do stěny břišní v místě trokárových incizí. Metastatické postižení břišní stěny je ovšem také spojeno s operacemi provedenými otevřeným způsobem.
U laparoskopicky operovaných u pacientek s vysokým maligním potenciálem a rizikem exfoliace nádorových buněk se doporučuje zahájit včas adekvátní onkologickou léčbu.
Regionální lymfadenektomie. Kontroverze v otázce přínosnosti a rizika pánevní a paraaortické lymfadenektomie je v současné době názorově stabilizována zejména na základě rozsáhlé studie Trimbleho a spol. (1998). Autoři revidovali údaje ze souboru 9185 žen z National Cancer Institute’s Surveillance, Epidemiology v USA a prokázali statistickou významnost zlepšení intervalu přežití u žen s karcinomem endometria I a G3, kde byla jako součást operační léčby provedena lymfadenektomie. Nesignifikantní zlepšení bylo zjištěno u žen s gradingem 3 a stadiem Ib, c nebo II. K těmto údajům by se mělo přihlédnuto při tvorbě nových protokolů managementu karcinomu endometria a následně je ověřit v rozsáhlých meta-analytických studiích.
Schéma operačního managementu je v Tab. 4 a v Tab. 5.
Abdominální hysterektomie, adnexektomie, laváž s event. regionální lymfadenektomií u žen s nízkým rizikem, resp. vysokým rizikem je metodou volby při kontraindikaci či nemožnosti laparoskopického řešení.
Vaginální hysterektomie s adnexektomií zůstává vyhražena pro skupinu starších žen s vysokým interním rizikem, nízkým maligním potenciálem a descenzem rodidel.
Radikální hysterektomie. Pod pojmem radikální hysterektomie rozumíme operaci indikovanou u žen s karcinomem těla dělohy a rozšířením do hrdla (IIa, b), nejčastěji v modifikaci podle Werthei ma, stupeň radikality III. Nebyly prokázány statisticky významné rozdíly v pětiletém přežití pacientek operovaných pro druhý stupeň CE radikálním způsobem, ve srovnání s výsledky u žen po totální extrafasciální hysterektomii.
Radiační terapie
Samostatná radiační léčba bývá ve většině zemí vyhrazena pro pacientky, u kterých je nádorová choroba pokročilá nebo stav pacientky nedovoluje léčbu operační. V komparativních studiích (Nilsen, Bickenbach) byl interval pětiletého přežití u pacientek léčených radiací pouhých 67,8 %, resp. 69 %, ve srovnání s 98 %, resp. 87 % u žen po hysterektomii.
Kombinovaná léčba radiační a chirurgická
Existuje široká paleta schémat pro externí nebo intrakavitární radiaci použitou jak před operací, tak po operaci. Ačkoliv nebyl prokázán statisticky významný rozdíl v pětiletém přežití mezi pacientkami léčenými pouze operativně (75 %) a kombinovaně (78 %) operací a zářením, doporučuje Jones (1975) kombinovat léčbu radiační a operační z důvodu snížení incidence poševních recidiv a ovlivnění metastáz v lymfatických uzlinách. V recentní studii Larsona a spol. (1998) bylo dosaženo výtečných výsledků při operační léčbě (hysterektomie, pánevní a paraaortické lymfadenektomie) i u žen s vysokým rizikem malignity.
Adjuvantní léčba
Hormonální léčba
Steroidní receptory. Přestože zbývá ještě mnoho nejasností v metodologii a terminologii steroidních receptorů, je pozice estrogenních receptorů (ER) a progesteronových receptorů (PR) v hodnocení prognózy CE a plánování individuální strategie poměrně zřetelně definována. V kumulativním přehledu světové literatury je udávána kladná odpověď na léčbu progesteronem u 71 % žen s pozitivním PR v porovnání jen s 10 % odpovědí u PR negativních žen.
Adjuvantní léčba progesteronem. U pacientek ze skupiny nízkého rizika je zisk z adjuvantní léčby progesteronem poměrně malý. Ve skupině žen s vysokým rizikem jsou výsledky léčby stále ještě nejisté a je zapotřebí dalších studií, které by zhodnotily zejména závažnost vedlejších a nežádoucích účinků vysokých dávek progesteronu (např. diabetes mellitus).
Léčba progesteronem u pokročilých stadií karcinomu endometria nebo recidiv. Počet pozitivních odpovědí na léčbu progesteronem se pohybuje v rozmezí 11–33 % u žen s pokročilou formou CE nebo recidivou. Příznivější odpovědi lze očekávat u pacientek s vysoce diferencovanými tumory a tam, kde je delší interval mezi primární léčbou a recidivou. Kombinace progesteronu s chemoterapií nezlepšuje interval přežití (Kaupilla,1984). Klinické hodnocení senzitivity PR může být užitečné v predikci senzitivity léčby.
Tamoxifen. Přítomnost ER v endometroidních tumorech poskytuje racionální zdůvodnění pro použití tamoxifenu v léčbě karcinomu endometria.
Radioterapie
Následující léčebné procedury jsou ve většině zemí běžně akceptovány u vysoce nebo středně rizikových žen s karcinomem endometria:
předoperační zevní radiace,
předoperační intrakavitární radiace,
pooperační radiace.
Zevní záření (external beam radiation – EBR). Pooperační radiace je doporučena pro pacientky z high risk skupiny. Tato léčba je obvykle součástí kombinované léčby – EBR pánve a brachyterapie poševní jizvy. Radiace může být aplikována anterioposteriorně a posteroanteriorně na ohraničené pole nebo čtyřpolní box technikou. Rozdělení celkové dávky 50 Gy na porce 1,8–2,0 v průběhu 4–5 týdnů bývá považována za dostatečné. Úplné ozáření břišní dutiny přichází v úvahu při pozitivním výsledku peritoneální laváže. Četnost komplikací předoperační a pooperační brachyterapie je srovnatelná (Calais,1990). Komplikace se vyskytují nejčastěji v podobě závažné formy cystitidy, proktitidy, poševní stenózy a vzácně střevní obstrukce. Vaginální nekrózy nebo vezikovaginální píštěle jsou vzácné a obvykle souvisí s velikostí dávky kombinované zevní a poševní radiace.
Chemoterapie cytostatiky
Radiační léčba snižuje výskyt místních recidiv, ale ne již vzdálených. Nezlepšuje interval přežití v porovnání s výsledky u operovaných žen. Cytostatické léky jsou používány v (paliativní) léčbě recidiv nebo v léčbě pokročilých primárních nádorů (cisplatina-C, karboplatina, doxorubicin-A, cyklofosfamid-P, fosfouracil-F a Vinca alkaloidy). Kombinovaná terapie ve schématech C-A-P, C-A-F a C-F prokazuje větší podíl remisí než monoterapie. Nicméně tyto remise jsou jen částečné a mají krátké trvání (šest měsíců).
Děložní sarkomy
Sarkomy tvoří asi 3–4 % z malignit dělohy. Z myometria vznikají leiomyosarkomy a čistě stromální nebo smíšené mezodermální nádory vznikají z endometria nebo sliznice děložního hrdla.
Epidemiologie a etiologie
Incidence smíšených mezodermálních děložních sarkomů je ve středním věku velmi nízká, ale poté prudce vzrůstá. Na druhé straně vzestup incidence děložního myosarkomu je pozvolný s vrcholem mezi 40–50 lety, a poté dochází k poklesu. V této souvislosti byla vyslovena domněnka, že rozdíly ve věkové incidenci mezi oběma typy sarkomů jsou důsledkem rozdílné etiologie.
Klinické projevy
Nejčastějším klinickým projevem je děložní krvácení. Ostatní symptomatologie je obtížně rozlišitelná od benigních forem jiných děložních nádorů. V předoperační diagnostice je nejvíce přínosná kyretáž v porovnání s cytologií a ultrasonografií.
Chirurgická terapie
Obecně akceptovanou chirurgickou metodou u I. stupně onemocnění je extrafasciální hysterektomie. Při postižení parametrií nebo hrdla by měla být provedena radikální operace podle Wertheima typ III. Odstranění adnex je doporučeno vždy, pokud je známa diagnóza, spolu s provedením peritoneální, omentální a uzlinové biopsie. Je sporné, zda kompletní lymfadenektomie přináší pacientce prospěch, ale odstranění postižených zvětšených uzlin je plně indikováno.
Adjuvantní terapie
Radiace
Z literárního hodnocení není úloha adjuvantní radiace zcela zřejmá, ale z autorských popisů vyplývá, že zevní radiace je rutinně používána jako adjuvantní léčba. U pacientek s postižením lymfatických uzlin je použití radiace rozšířeno na paraaortální oblast.
Chemoterapie
Použití cytostatik se nabízí jako vhodná léčebná metoda, především vzhledem ke sklonu k hematogennímu rozsevu děložních sarkomů. Použití kombinace cisplatiny a adriamycinu, dále vin kristinu, aktinomycinu a cyklofosfamidu, vedlo ve studiích Peterse a spol. (1989), resp. Hannigana a spol. (1984), ke snížení počtu recidiv u léčených žen. Otevřenou otázkou ale zůstalo nalezení vhodných a účinných látek a také zhodnocení kvality života léčených pacientek.
Hormonální terapie
Použití progesteronu a antiestrogenů nebylo v I. linii léčby účinné. Výsledky studií s použitím analog gonadoliberinu v léčbě sarkomů ve větších souborech nejsou zatím k dispozici.
ACKERMAN, LV., ROSAI, J. Surgical Pathology. 5th ed., St. Luis : Mosby Company, 1394 p.
BLASS, JD., BERMAN, ML., BLASS, LP., et al. Use of vaginal hysterectomy for the management of stage I endometrial cancer in medically compromited patients. Gynecol Oncol, 1991, 40, p. 74–77.
BURGARDT, E., WEBB, MJ., MONAGHAN, JM., et al. Surgical Gynecologic Oncology. Stuttgart : Georg Thieme, 1993, 729 p.
CALAIS, G., VITU, L., DESCAMPS, P., et al. Preoperative or postoperative brachyterapy for patients with endometrial carcinoma stage I and II. Int J Radiat Oncol Biol Phys, 1990, 19, p. 523–527.
COWLES, TA., MAGRINA, JF., MASTERSON, BJ., et al. Comparison of clinical and surgical staging in patients with endometrial carcinoma. Obstet Gynecol, 1985, 66, p. 413–416.
CREASMAN, WT., MORROW, CP., BUNDY, BN., et al. Surgical pathologic spread patterns of endometrial cancer. Cancer, 1987, 60, p. 2035–2041.
GIMPLESON, RJ., RAPPOLD, HO. A comparative study between panoramic hysteroscopy with directed biopsies and dilatation and curretage. Am J Obstet Gynecol,1988, 158, p. 489–492.
GUSBERG, SB. Diagnosis and principles of treatment of cancer of the endometrium. In GUSBERG, SB., SHINGLETON, HM., DEPPE, G. (Eds), Female Genital Cancer. New York : Churchill Livingstone, 1988, p. 337–360.
HOLUB, Z., VORÁČEK, J., SHOMANI, A. A comparison of laparoscopic surgery of endometrial cancer with open procedure. Eur J Gynec Oncol, 1998, 19, p. 294–296.
HOLUB, Z. Úloha laparoskopické hysterektomie v chirurgické léčbě chorob ženského reprodukčního systému. 1. vydání, Praha : Galén, 2000, 159 s.
CHRISTOPHERSON, WM., CONNELLY, PJ., ALBERHASKY, RC. Carcinoma of the endometrium, 5: a analysis of prognosticators in patients with favourable subtypes and Stage I disease. Cancer, 1983, 51, p. 1705–1709.
MASSI, G., SAVINO, L., SUSUNI, T. Vaginal hysterectomy versus abdominal hysterectomy for the treatment of stage I endometrial carcinoma. Am J Obstet Gynecol, 1996, 174, p.1320–1326.
MUTTLER, GL., and the Endometrial Collaborative Group. EIN: Will it bring order to chaos. Gynecol Oncol, 2000, 76, p. 287– 290.
TRIMBLE, EL., KOSARY, C., PARK, RC. Lymph node sampling and survival in endometrial cancer. Gynecol Oncol, 1998, 71, p. 340–343.
e-mail: HolubZ@seznam.cz
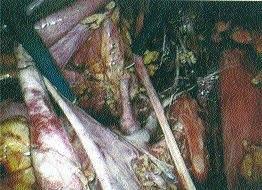
Obr. 1 – Stav po laparoskopickém odstranění lymfatických uzlin z pravé poloviny pánve. Pořadí struktur zleva doprava: 1. zevní pánevní cévy, 2. obturatorní cévy, 3. obturatorní nerv, 4. m. psoas
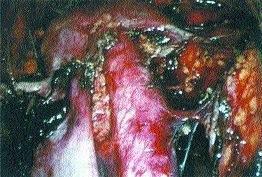
Obr. 2 – Stav po laparoskopické infrarenální paraaortální lymfadenektomii. Nahoře vlevo vyústění v. ovarica l. dx. do v. cava caudalis, vpravo dole odstup a. mesenterica inf. z aorty
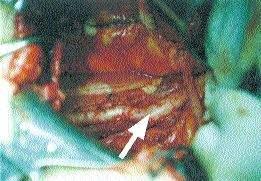
Obr. 3 – Laparotomický přístup k pánevním cévám vpravo a k dolní části aorty a v. cava caudalis (označeno šipkou)
Literatura
