Další část publikace je věnována problematice vhodného hodnocení bolesti u osteoartrózy, a to jak v běžné klinické praxi, tak v rámci výzkumu a lékových studií. Autor doporučuje používat algezimetrické pomůcky i v rámci běžné klinické praxe. V další části jsou popsána dvě zásadní doporučení pro léčbu gonartrózy a koxartrózy, která byla částečně vytvořena na základě evidence v rámci medicíny založené na důkazech. Jde o doporučení Evropské ligy proti revmatismu (EULAR) a doporučení Organizace na výzkum artrózy (OARSI). Mají řadu společných bodů, ale jsou zde i určité odlišnosti.
Cílem léčby je snížit bolest a zlepšit funkci, zlepšit mobilitu, zlepšit kvalitu života, snížit fyzickou disabilitu a handicap a zpomalit rentgenovou progresi osteoartrózy. Zdůrazněna je nutnost individuálního terapeutického plánu pro každého pacienta, který zohledňuje individuální charakteristiky jeho nemoci, věk, komorbidity, další farmakoterapii i očekávání pacienta. Léčba každé osteoartrózy by měla být komplexní a skládat se z léčby nefarmakologické, farmakologické a v případě potřeby i chirurgické. Z farmakoterapie existuje evidence o účinnosti paracetamolu, nesteroidních antirevmatik, i. a. glukokortikoidů, kyseliny hyaluronové, glukosaminu, chondroitin sulfátu, diacereinu, lokálních nesteroidních antirevmatik a kapsaicinu a slabých a silných opioidů.
Summary
Pavelka, K. Pain in osteoarthritis
In the introductory part of this article the author deals with classification criteria for osteoarthritis and problems of early diagnosis. Heterogeneity of osteoarthritis is also emphasized. In the next section the author discusses the mechanism of pain occurrence, which is complex and pain nociception probably occurs in all joint tissues with the exception of hyaline articular cartilage, which doesn't have its own nerve endings. The phenomenon of peripheral and central nervous sensitization, typical for osteoarthritis, is also highlighted. Another part of the publication is devoted to the issue of appropriate assessment of pain in osteoarthritis, both in routine clinical practice and in research and pharmaceutical studies. The author recommends using algezimetric aids within routine clinical practice too. In the next section two major recommendations for treatment of gonarthrosis and coxarthrosis, which were partially created on the basis of evidence in the frame of evidence-based medicine, are described.
It is the recommendation of the European League against Rheumatism (EULAR) and the recommendation of the Organization for Research of Arthritis (OARSI). They have many common points, but there are also some differences. The aim of treatment is to reduce pain and improve function, improve mobility, improve quality of life, reduce physical disability and handicap and slow radiological progression of osteoarthritis. The necessity of an individual therapeutic plan for each patient, taking into account the individual characteristics of his illness, age, comorbidity, other drug therapies, and his expectations is emphasized. Treatment of each OA should be comprehensive and consist of non-pharmacological and pharmacological treatment, and, if necessary, surgery. In pharmacotherapy, there is evidence of the effectiveness of paracetamol, NSAIDs, i.a. glucocorticoids, hyaluronic acid, glucosamine, chondroitin sulfate, diacerein, local NSAIDs and capsaicin, and weak and strong opioids.
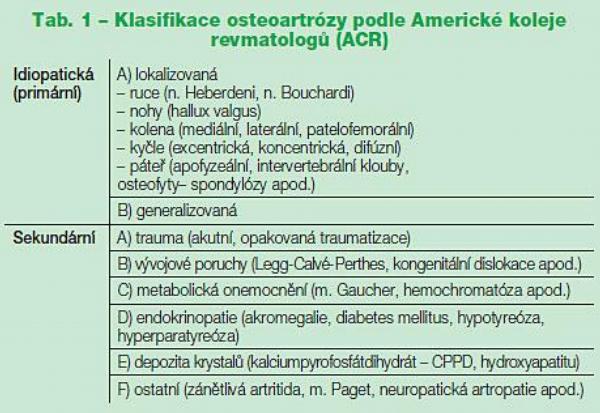
Osteoartróza (OA) je celosvětově nejčastějším kloubním onemocněním a je závažnou příčinou chronické muskuloskeletální bolesti, zhoršení funkce a disability u starší populace.(1) Nejčastější lokalizací OA jsou kolenní klouby, následují kyčelní klouby, drobné klouby rukou a klouby na páteři, ale v principu může být osteoartrózou postižen jakýkoliv kloub. V populaci nad 65 let trpí bolestmi kyčelních nebo kolenních kloubů až 40 % populace.(2) Osteoartróza je patofyziologicky, klinicky, strukturálně i prognosticky velmi heterogenní onemocnění. Z různých pohledů se dá klasifikovat na OA primární a sekundární, podle počtu postižených kloubů na lokalizovanou, oligoartikulární či polyartikulární (v případě postižení více než tří kloubních skupin hovoříme o OA generalizované). Při přítomnosti erozí na rtg snímku hovoříme o OA erozívní (Tab. 1). Lépe než jako o klinické entitě je hovořit o OA jako o klinickém syndromu.
Bolest u osteoartrózy
Bolest je nejdůležitějším symptomem u OA, který také přivádí pacienta do ordinace. Bolest je rovněž zásadním kritériem pro diagnózu OA. Při diagnostice OA lze užít např. kritéria Koleje amerických revmatologů (pro kyčelní, kolenní a ruční klouby),(3) přičemž ve všech je uvedena bolest (po většinu dní v posledním měsíci) jako nutné klinické kritérium pro diagnózu (Tab. 2). Toto je velmi důležité si uvědomit, protože samotné rentgenové změny pro diagnózu OA nepostačují.

Mechanismus vzniku bolesti u osteoartrózy
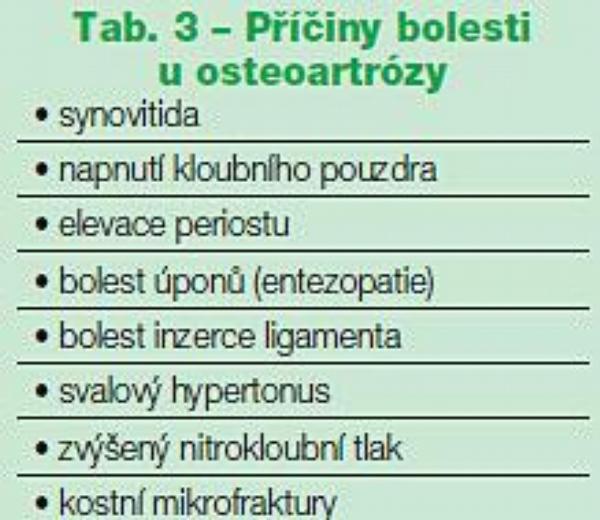
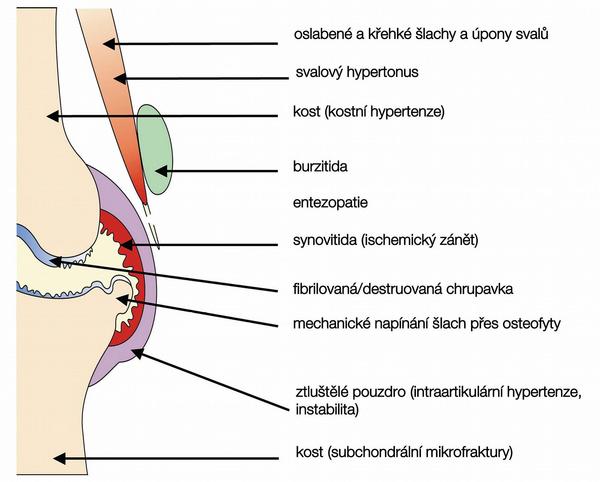
Mechanismus vzniku bolesti u OA není jednotný, což vyplývá jak z heterogenity onemocnění, tak i z různé vývojové fáze OA u jednotlivého pacienta. Možné příčiny bolesti jsou uvedeny v Tab. 3. Primárním místem strukturálních změn u OA je hyalinní kloubní chrupavka, která však je aneurální a avaskulární, takže primárně ani zdrojem bolestivých podnětů být nemůže. Bolest vyvolávají až sekundární změny na dalších kloubních tkáních – synoviální membráně, periostu, úponech vazů, inzercích svalů a v subchondrální kosti (viz Obr.). Relativně častým zdrojem bolesti u OA je synovitida. O přítomnosti zánětu je často možné se přesvědčit i klinicky. Kloub bývá oteklý a palpačně citlivý, někdy i teplejší. Oteklý kloub může být následkem jak výpotku, tak ztluštění synoviální membrány. Při přítomnosti zánětu mívá bolest někdy i klidový charakter a přibližuje se kvalitou bolesti při zánětlivých revmatických onemocněních. Přítomnost zánětu je možné dokumentovat i přítomností výpotku.
Tento výpotek však mívá menší počet buněk než 2000 v µl, protože intenzita zánětu je daleko menší než např. u revmatoidní artritidy. Histologicky je zánět přítomen v synoviální membráně, je však často lokalizován na určité okrsky, rovněž jeho intenzita je nižší než u revmatoidní artritidy (RA), kdy ztluštění synoviální membrány nedosahuje zdaleka takové šířky jako u primárně zánětlivých revmatických onemocnění. Přítomnost zánětu také vysvětluje dobrý analgetický efekt perorálně podávaných nesteroidních antirevmatik či intraartikulárně podávaných glukokortikoidů. Dalším zdrojem bolesti mohou být kostní mikrofraktury v subchondrální kosti. Experimentální práce ukázaly změny v kvalitě subchondrální kosti u OA a vyvolaly i několik studií, které aplikovaly kostně aktivní léky (např. risedronát, ranelát sodný) ve snaze po symptomatickém, ale i strukturálním efektu u OA. Studie zatím nepřinesly pozitivní výsledky, některé ještě nebyly dokončeny.
Dalším zdrojem bolesti zvláště u velkých kloubů (kyčel, koleno) může být zvýšený nitrokostní tlak, který vzniká pravděpodobně následkem venózní obstrukce. Může být příčinou nočních bolestí. Úleva od bolesti, která nastává často brzy po operaci (např. aloplastice), může souviset právě s odstraněním tohoto zvýšeného nitrokostního tlaku. Dalším zdrojem bolesti může být kloubní pouzdro, a to při zvýšeném nitrokloubním tlaku při extenzi výpotkem nebo synoviální hypertrofií, dále při mechanických problémech při nestabilitě kloubu, kdy mohou být přímo drážděny mechanoreceptory v kloubním pouzdře, a dále při fokální ischémii kloubního pouzdra. Zdrojem kloubní bolesti může být i nitrokloubní periost, který může být mechanicky drážděn osteofyty. Kromě nitrokloubních struktur může bolest pocházet i ze struktur mimokloubních, tzv. periartikulárních. K nim patří burzitida, tendinitida, entezopatie či entezitida, natažení vazů. Významným zdrojem bolestí u OA mohou být i svaly, a to při jejich slabosti či dysbalanci.
Normální kloubní tkáně se zdají být relativně málo citlivé na bolestivé stimuly, protože lze předpokládat, že při nízkém prahu bolesti by i normální pohyby v kloubu byly bolestivé. Existuje určitý důkaz o tom, že tzv. periferní nervová senzitizace, zprostředkovaná nervovými růstovými faktory a cytokiny, je základním rysem OA.(4) Bolestivá senzitizace byla popsána i na spinální a kortikální úrovni. Konečně je bolest modulována psychologickými, sociálními a dalšími faktory.
Pokud máme charakterizovat bolest u OA z hlediska patofyziologického, jde o typickou nociceptivní bolest. Nicméně byla publikována některá data, která mohou svědčit i o významném podílu bolesti neuropatické.(4)
Hodnocení bolesti u osteoartrózy
Vyhodnocení symptomu bolesti u OA je velmi důležité – jak pro vlastní diagnózu, tak pro navržení terapeutického plánu, který by měl být vytvořen individuálně pro každého pacienta. Vyhodnocení bolesti je nutné jak v běžné klinické praxi, tak v rámci výzkumu a lékových studií.
Prvním důležitým atributem při bolesti u OA je otázka, jde-li o bolest klidovou, či o bolest námahovou, která vzniká při zatěžování kloubů. Důležitý je i typ a intenzita zátěže, kdy bolest vzniká. Např. prvním typem bolesti bývá bolest kolenních kloubů při gonartróze při chůzi ze schodů či nahoru po schodech. Bolest klidová je zpravidla závažnějším projevem. Může být projevem zánětu, někdy se hovořilo o zánětlivé dekompenzaci OA, iritaci či v anglické nomenklatuře o „flare“. V pozdějších stadiích OA může být klidová bolest již příznakem závažné destrukce kloubu. Určitým typem klidové bolesti je bolest noční, která např. v lokalizaci kyčelních kloubů pacienta velmi obtěžuje tím, že ruší jeho spánek. Pacienti s OA ručních kloubů mají naopak největší bolesti ráno. Tyto bolesti bývají spojeny s ranní ztuhlostí. Ztuhlost však nebývá na rozdíl od revmatoidní artritidy delší než 30 minut.
Dalším důležitým atributem bolesti u OA je její časový profil. Prvním typem bolesti je bolest kontinuální, druhým typem bolesti pak bolest intermitentní. Při výzkumu bolesti u OA v kanadské studii nejčastěji pacienti tento typ bolesti označovali jako bolest, která přichází a odchází (pain which comes and goes) a přesně podle této dikce byl také navržen nový OARSI dotazník na bolest u gonartrózy a koxartrózy. Třetím atributem bolesti u OA je její intenzita. Bolest je subjektivní údaj pacienta a jako taková je objektivně neměřitelná. Nicméně byla navržena a v praxi je běžně používána celá řada metrologických ukazatelů pro hodnocení bolesti. Nejběžnější je jednoduchá škála bolesti, buď ve formě úsečky v podobě tzv. vizuální analogové škály (VAS), nebo ve formě několika slovních kategorií (např. bolest velmi silná, silná, střední, mírná, žádná), které se nazývají Likertovy škály. Kromě těchto jednoduchých pomůcek se používají i dotazníky na hodnocení bolesti a zhoršení funkce.
Nejpoužívanější je tzv. dotazník WOMAC (Western Ontario and Mac Master Universities Osteoarthritis Index),(5) který jsme validizovali pro užití v českém jazyce.(6) Dotazník WOMAC má tři části – část A obsahuje 5 otázek na bolest, část B 2 otázky na ztuhlost a část C 17 otázek na aktivity denního života. Pro vlastní hodnocení bolesti se nejčastěji používá průměr z 5 otázek (každá má odpověď na škále 0–100 mm) ze sekce A, nebo první otázka sekce A (Jaká je vaše bolest při chůzi po rovině?). V současné době vypracovává pracovní skupina OARSI dotazník nový.(7) Používání výše popsaných algeziometrických pomůcek ve výzkumné práci či lékových studiích je běžné a jejich výběr je úkolem akademiků či klinických farmakologů, kteří navrhují protokoly studií. V běžné klinické praxi se bolest neměří zpravidla vůbec, což jistě není dobré pro optimální léčbu bolesti. Přitom např. použití VAS je nesmírně rychlé a jednoduché a nic nestojí.




Léčba osteoartrózy
Léčba osteoartrózy kolenních a kyčelních kloubů by se měla zaměřit na dosažení následujících cílů:(8)
1. Zmenšit bolest a ztuhlost.
2. Uchovat a zlepšit pohyblivost.
3. Zmenšit fyzickou disabilitu a handicap.
4. Zlepšit kvalitu života závislou na zdraví.
5. Omezit progresi kloubní destrukce.
6. Vzdělávat pacienty o charakteru onemocnění a principech léčby.
Terapeutický plán by měl být individualizován pro každého pacienta. Měly by být zváženy následující faktory: rizikové faktory progrese gonartrózy (koxartrózy), jako je obezita, nepříznivé mechanické faktory, fyzická aktivita, dále celková zdravotní rizika pacienta (věk, komorbidita, polypragmazie), stupeň bolesti a disability, příznaky zánětu (např. výpotek) a lokalizace a stupeň strukturálního postižení.
O významu hodnocení strukturálního postižení u OA je nutné se zmínit zvlášť, protože v klinické praxi bývají interpretace a význam morfologického hodnocení často nesprávné. Zlatým standardem pro hodnocení artrózy je stále standardně provedený rentgenový snímek. Konkrétně u gonartrózy to znamená předozadní a boční snímek u stojícího pacienta s extendovanými kolenními klouby. Při hodnocení v běžné klinické praxi se snímky stále hodnotí podle Kellgren Lawrence(9) a zařazují se do čtyř stadií (I–IV). Na skupinové úrovni platí, že pacienti ve vyšším stadiu mají i větší bolesti, ale na úrovni jedince existuje často rozpor mezi subjektivními obtížemi pacienta a rentgenovým stupněm jeho artrózy. Je možné občas vidět pacienty, kteří i při pokročilém rentgenovém nálezu mají minimální či žádné obtíže, naopak každý zná ze své ordinace pacienty, kteří mají velké bolesti, časté výpotky a musí užívat NSA a přitom rtg nález je minimální či žádný. Rentgenový snímek je tedy jen jeden z faktorů, který je důležitý především pro diagnózu, ale rozhodně nemůže být jediným (a ani nejdůležitějším) faktorem, který determinuje terapeutický plán léčby.
Doporučení pro léčbu osteoartrózy kolenních a kyčelních kloubů
V posledních 10 letech bylo publikováno několik doporučení pro léčbu, která na základě principů medicíny založené na důkazech vytvořily pracovní skupiny Evropské ligy proti revmatismu (EULAR) (Tab. 4)(10) nebo Mezinárodní organizace pro výzkum osteoartrózy (OARSI).(8) Pracovní skupina OARSI zkoumala celkem 51 navržených léčebných modalit u gonartrózy a koxartrózy a evidenci o účinnosti našla u 20 modalit. Doporučení vydala ve formě 25 bodů. Terapeutické intervence (modality) jsou rozděleny na nefarmakologické (celkem 12) (Tab. 5), farmakologické (celkem 8) (Tab. 6) a chirurgické (celkem 5) (Tab. 7). Podle prvního bodu doporučení by měl být každý pacient léčen kombinací farmakologických a nefarmakologických postupů. Velikost účinku v randomizovaných studiích i u nefarmakologických postupů byla signifikantně vyšší než u placeba, ale při hodnocení mírná (ES pro úlevu od bolesti 0,25, 95 % CI 0,6–0,3), při hodnocení farmakologických postupů byla velikost střední (ES pro úlevu od bolesti 0,39, 95 % CI 0,31–0,47). Z nefarmakologických modalit jsou doporučeny: vzdělávání a samoléčba pacienta, telefonický kontakt edukovanou sestrou s pacientem, odeslání pacienta na odborné pracoviště fyzioterapeuta, redukce váhy, používání opěrných pomůcek, používání kolenních ortéz, vhodná obuv včetně speciálních podpatěnek, cvičení (aerobní, posilování svalů a rozsahu pohybu, cvičení ve vodě), termální procedury, transkutánní nervová stimulace a akupunktura.
Z farmakologických modalit jsou doporučeny: paracetamol, COX2 selektivní i neselektivní nesteroidní antirevmatika, topicky používaná nesteroidní antirevmatika a kapsaicin, intraartikulárně aplikované glukokortikoidy a kyselina hyaluronová, glukosamin sulfát a chondroitin sulfát pro symptomatický efekt, glukosamin sulfát, chondroitin sulfát pro strukturální efekt u gonartrózy, diacerein pro strukturální efekt u bolestivé koxartrózy a opiodní analgetika.
Z chirurgických modalit jsou doporučeny totální náhrada kloubu, unikompartmentální náhrada kloubu, osteotomie a další chirurgické procedury k záchraně povrchu kloubní chrupavky a kloubní artrodéza jako záchranné řešení v případě selhání aloplastiky.
Strategie farmakologické léčby bolesti
K symptomatické léčbě bolesti lze jako lék první volby aplikovat paracetamol nebo nesteroidní antirevmatika. Problematice účinnosti paracetamolu u OA a srovnání účinnosti paracetamolu a nesteroidních antirevmatik u OA bylo věnováno několik metaanalýz a přehledných prací v domácí i zahraniční literatuře.(11, 12) Závěry Zhangovy metaanalýzy lze shrnout do několika bodů: 1. paracetamol je účinný v léčbě bolesti u OA (ES 0,21, 95 % CI 0,02–0,41); 2. NSA jsou účinnější než paracetamol (ES 0,20, 95 % CI 0,1–0,3); 3. počet pacientů, kteří preferují NSA, je vyšší než počet pacientů preferujících paracetamol (RR 2,46 95 % CI 1,5–4,12); 4. NSA vyvolávají častěji gastrointestinální dyskomfort a nežádoucí účinky (RR 1,35 95 % CI 1,05–1,75).
Na základě výše uvedených analýz Zhang uzavírá a doporučuje, že paracetamol je u OA účinný lék, ale jeho účinnost je slabší než u nesteroidních antirevmatik. Z bezpečnostních důvodů by měl být lékem první volby při léčbě bolesti u OA (a pokud je dostatečně účinný, měl by být aplikován i dlouhodobě). K uvedeným závěrům ještě několik poznámek. Jednou z příčin neúspěchu léčby v praxi s paracetamolem je nedostatečná dávka, a to jednotlivá i celková denní. Při intenzívnější bolesti je nutné aplikovat dávky do 3–4 g denně. Paracetamol má rovněž krátký poločas a je ho nutné aplikovat 4–6krát denně. Poněkud lepší je situace u retardovaných preparátů. Paracetamol je také možné kombinovat s nesteroidními antirevmatiky nebo opioidy. Paracetamol je také relativně velmi levný.
Nesteroidní antirevmatika (NSA) užívá podle průzkumů 50–70 % se symptomatickou OA.
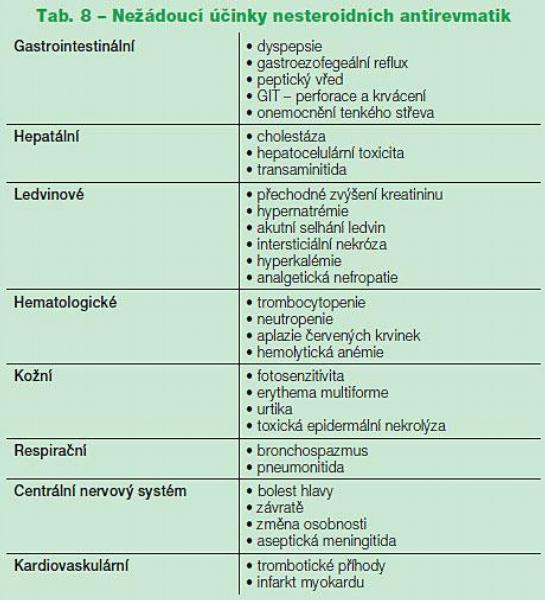
NSA jsou doporučována k léčbě bolesti u OA ve všech publikovaných doporučeních. Metaanalýza 10 velkých, randomizovaných, dvojslepých studií s více než 10 tisíci pacienty prokázala účinnost NSA oproti placebu, nicméně velikost účinku byla relativně malá (ES 0,32, 95 % CI 0,24–0,39).(13) Prakticky všechny studie u OA jsou krátkodobé (kratší než 1 rok), takže lze říci, že o dlouhodobém účinku NSA u artrózy se mnoho neví. Některé starší studie dokonce prokazovaly možný škodlivý vliv NSA na chrupavku a rychlejší rtg progresi OA při dlouhodobé aplikaci NSA (tzv. analgetický kloub), toto se však nikdy nepodařilo prokázat. NSA mají poměrně značnou toxicitu nejen gastrointestinální, ale i kardiovaskulární a renální (Tab. 8).(14, 15) Osteoartróza postihuje především starší populaci, u které je výskyt nežádoucích účinků po NSA vyšší. Multipatologie ve stáří narušuje funkce orgánů zodpovědných za farmakokinetiku. U starších lidí je léčeno často více chorob současně a stoupá riziko interakcí. V praxi je např. časté podávání NSA a současně malých dávek kyseliny acetylsalicylové (ASA) jako prevence ischemické choroby srdeční. Tyto malé dávky ASA však GIT toleranci NSA zhoršují. Lepší GIT toleranci mají selektivní COX-2 inhibitory, tzv. koxiby. U nás jsou v současné době dostupné celekoxib a etorikoxib, které byly také s úspěchem zkoušeny v randomizovaných studiích u artrózy. Vyšší výskyt kardiovaskulárních (CV) trombotických příhod po aplikaci koxibů je stale diskutován. Jednoznačně byl častější po vyšších dávkách rofekoxibu, který byl také stažen z distribuce. Evidence u celekoxibu(16) a etorikoxibu není jednoznačná. (17) Srovnávací metaanalýza řady studií nepotvrdila signifikantní rozdíl ve výskytu kardiovaskulárních příhod mezi COX2 selektivními a neselektivními NSA.(15) Současné doporučení EMEA kontraindikuje použití koxibů u pacientů s ICHS nebo cévní mozkovou příhodou a doporučuje velkou opatrnost u pacientů s rizikovými faktory ICHS (hypertenze, hyperlipidémie, diabetes a kouření, ischemická choroba končetin).(18) V USA mají COX-2 selektivní i neselektivní NSA stejné varování na riziko GIT a kardiovaskulárních nežádoucích účinků.
Pro aplikaci NSA u osteoartrózy lze shrnout doporučení do následujících bodů:
1. Podávat NSA až v případě nedostatečného efektu nefarmakologických opatření a paracetamolu.
2. Používat NSA v nejnižších účinných dávkách po nejkratší možnou dobu (např. po dobu vzplanutí bolesti).
3. Používat na principu on demand jen když potřebuji, nikoliv fixně. Vybrat podle aktuální potřeby pro pacienta NSA s vhodným biologickým poločasem.
4. Respektovat GIT a kardiovaskulární rizika nemocných.
U pacientů s GIT riziky používat tzv. efektivní gastroprotektivní princip – tj. buď aplikaci koxibů (u pacientů bez kardiovaskulárního rizika), anebo kombinaci neselektivního NSA s inhibitory protonové pumpy.(19) U pacientů s menším stupněm bolesti a zvláště u menších kloubů lze použít NSA i v lokální formě. Metaanalýza kontrolovaných studií prokázala účinnost lokálních NSA u gonartrózy a OA rukou, nikoliv u koxartrózy.(20)
Aplikace opioidů k léčbě bolesti u osteoartrózy
Aplikace opioidů k symptomatické léčbě bolesti je doporučována ve všech publikovaných důležitých doporučeních.(8, 10) Byla také provedena řada metaanalýz a kritických, přehledných prací. Analýza 18 placebem kontrolovaných, randomizovaných studií u OA prokázala dobrý účinek v léčbě bolesti (ES = 0,78, 95 % CI 0,59–0,98).(21) Nicméně mezi jednotlivými studiemi byly velké rozdíly podle typu užitého preparátu a typu studie. Většina studií však byla krátkodobých (12 týdnů a méně). Vliv na zlepšení funkce byl pouze malý. Přínosy léčby však byly snižovány častými nežádoucími účinky, jako jsou nauzea (30 %), zácpa (23 %), nevolnost (20 %), somnolence (18 %) a zvracení (13 %). Celkem 25 % pacientů ve skupině přerušilo léčbu pro nežádoucí účinky oproti 7 % na placebu.
Přerušení léčby však bylo častější pro silné opioidy – 31 % (oxymorfon, oxykodon, fentanyl, deriváty morfinu) – než pro opiody slabé – 19 % (tramadol, tramadol/paracetamol, kodein, propofyxen).
Slabé opioidy jsou indikovány k léčbě bolesti u OA u pacientů, kteří nemají dostatečnou úlevu od bolesti po NSA nebo kteří NSA netolerují. U pacientů s kontraindikací NSA mohou být používány i jako lék první volby.(22) Aplikace silných opioidů by měla být použita u případů velmi silné bolesti nereagující na ostatní prostředky a na časově omezené období. Příkladem může být tzv. průlomová bolest při finální destrukci kloubů u pacientů, kteří čekají na chirurgické řešení endoprotézou.(23) Aplikace opioidů by se měla řídit u OA obecnými návody pro aplikaci opioidů u chronické, nemaligní bolesti.
Intraartikulární aplikace glukokortikoidů
Lokální aplikace glukokortikoidů je ve všech doporučeních pro léčbu kolenních kloubů. Přestože jsou glukokortikoidy používány v této indikaci přes padesát let, randomizovaných studií bylo provedeno relativně málo. Metaanalýzu 13 placebem kontrolovaných studií s i. a. glukokortikoidy u gonartrózy provedl v rámci Cochranské analýzy Bellamy a spol.(24) Vliv na zmírnění bolesti byl po 2 a 3 týdnech signifikantní a středně velký (ES 0,72, 95 % CI 0,42– 1,02). V intervalu od 4–12 týdnů po injekci již efekt nebyl signifikantní. Efekt léčby i. a. glukokortikoidy u koxartrózy dokonce podporují pouze dvě randomizované klinické studie.
Lokální aplikaci glukokortikoidů tedy lze doporučit u pacientů s osteoartrózou, u kterých nebyl dostatečný efekt perorální léčby (např. NSA). Některé studie prokazují fakt, že účinnost léčby je lepší u pacientů s přítomností výpotku. Důraz je kladen na precizní injekční techniku s intraartikulární aplikací léku. Efekt léčby je však relativně krátkodobý (do 2–4 týdnů). Injekce by se neměla opakovat častěji než 4krát do roka.
Intraartikulární aplikace kyseliny hyaluronové
Kyselina hyaluronová (KH) je glykosaminoglykan o velké molekulové hmotnosti, který je součástí normální synoviální tekutiny. Při osteoartróze mění KH v synoviální tekutině své vlastnosti (např. je depolymerizována) a není schopná zcela plnit svoje fyziologické funkce (např. lubrikační). Externě aplikovaná KH do kloubů při OA se používá již přes 25 let.
Kladné stanovisko k aplikaci KH i. a. je obsaženo v 8/9 publikovaných doporučeních včetně EULAR a OARSI.(8, 10) Pravděpodobně nejdůležitější je metaanalýza 40 placebem kontrolovaných studií, která byla publikována v rámci Cochranské analýzy.(25) Po aplikaci série injekcí (3–5) docházelo k maximální úlevě od bolesti mezi 5.–13. týdnem a tato redukce činila proti bazálním hodnotám 28–54 %, u funkce pak byla redukce 9–32 %. Mezi studiemi je však velká heterogenita, což je dáno několika faktory, jako jsou např. existence velkého množství preparátů KH, které se liší molekulovou hmotností a původem, dále pak typem studií, indikačními kritérii a použitými ukazateli účinnosti. Obecně se dá říci, že KH je indikována u bolestivé gonartrózy, u které kombinovaná léčba nefarmakologickými postupy a analgetiky nebo NSA nepřinesla dostatečný efekt.
Pomalu působící léky u osteoartrózy
Pro pomalu působící léky u OA jsme si zvykli používat zkratku SYSADOA (SYmptomatic Slow Acting Drugs in OA). Název skupiny těchto léků již charakterizuje jejich základní vlastnosti – působí symptomaticky (snižují bolest a zlepšují funkci), a to s určitou latencí (obvyklý nástup analgetického účinku je 2–4 týdny), ale pak se jejich analgetická schopnost vyrovnává s NSA. Analgetický efekt SYSADOA přetrvává ještě 2–3 měsíce po skončení jejich aplikace, jak jsme prokázali např. ve studii s diacereinem.(26) Do této skupiny léků patří glukosamin sulfát, chondroitin sulfát, diacerein a výtažek z avokáda a sóji (tzv. ASU). Mechanismus účinku těchto léků není zcela jasný. Určitě nepůsobí přes inhibici cyklooxygenázy a přes inhibici prostaglandinů. Podstatou jejich působení je zásah do metabolismu hyalinní kloubní chrupavky, kde stimulují anabolické pochody (syntézu proteoglykanů, kolagenu) a inhibují katabolické pochody (inhibice cytokinů, metaloproteináz).
Glukosamin (GS) existuje ve formě sulfátu a hydrochloridu. Většina ranndomizovaných studií byla provedena s GS sulfátem, a to s preparátem, který je registrován jako lék (DONA). Evidence o účinnosti GS ve formě nutritivních doplňků je menší. Metaanalýza zahrnující 20 randomizovaných, dvojslepých studií ukázala 28% zlepšení bolesti (ES = 0,61 95 % CI 0,28–0,95) a 21% zlepšení funkce (ES 0,51 95 % CI 0,96–0,05).(27) Ve dvou dlouhodobých, tříletých studiích byl potvrzen i vliv GS na strukturální progresi enartrózy,(28, 29) tento efekt však bude nutné potvrdit v dalších studiích s novějšími zobrazovacími metodikami.
Chondroitin sulfát byl rovněž zkoušen v řadě studií a byla provedena řada metaanalýz a přehledných prací. Poslední metaanalýza byla publikována v roce 2007.(30) Metaanalýza je pozitivní, úleva od bolesti byla relativně velká (ES 0,75, 95 % CI 0,50–0,99). Ve třech studiích, z nichž nejdůležitější je studie STOPP,(31) byl zaznamenán signifikantní efekt na zpomalení progrese OA.
Diacerein je derivát antracenkarboxylové kyseliny. Jeho aktivní metabolit rein inhibuje syntézu IL-1, což je pravděpodobně nejdůležitější mediátor s aktivní účastí na destrukci chrupavky u OA. Diacerein byl rovněž zkoušen v řadě studií u gonartrózy a koxartrózy. V naší vlastní studii jsme prokázali, že analgetický efekt přetrvává ještě tři měsíce po ukončení léčby.(26) Metaanalýza klinických randomizovaných studií rovněž potvrdila klinickou účinnost diacereinu.(32) V jedné studii byl prokazatelný efekt na zpomalení progrese koxartrózy.(33)
Skupina SYSADOA je realitou současné léčby OA a ve většině doporučení je akceptována. Existují i negativní studie a i negativní metaanalýzy. Převažuje však pozitivní náhled založený na analýze kvalitních studií. Velkou výhodou SYSADOA je fakt, že mají minimálně nežádoucích účinků a prakticky vůbec nevyvolávají závažné nežádoucí účinky. Tím se striktně odlišují od NSA, což může být u řady, zvláště starších pacientů velmi významné. Prakticky všechna SYSADOA ovlivňují metabolismus chondrocytů, takže lze předpokládat tzv. chorobu modifikující efekt u OA, který však je vzhledem k metodologické náročnosti velmi těžké v humánní medicíně prokázat.
Závěr
Základem úspěšné léčby OA je včasná a přesná diagnostika, klasifikace onemocnění a eventuálně odstranění příčin sekundární OA. Nutné je pečlivé vyhodnocení subjektivních obtíží pacienta, především bolesti a poruchy funkce. Součástí nálezu musí být i objektivní kloubní vyšetření s posouzením přítomnosti zánětu a event. s nálezem biomechanických problémů. Vyhodnocení doplňuje strukturální nález na rtg snímku.
Terapie by měla být individualizována pro každého pacienta. Měla by být komplexní a vždy obsahovat nefarmakologickou léčbu. Z farmakologických prostředků existuje evidence o účinnosti paracetamolu, NSA, lokálně aplikovaných NSA a kapsaicinu, i. a. glukokortikoidů, slabých a silných opioidů, kyseliny hyaluronové, glukosaminu, chondroitin sulfátu a diacereinu.
O autorovi: Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav, Praha
e-mail: pavelka@revma.cz











