Karásek, P. Effective and safe treatment with panitumumab after a hypersensitivity reaction to cetuximab in patients with metastatic colorectal cancer
Targeted biological therapy with monoclonal antibodies affecting the EGFR receptors is currently an important part of anticancer therapy in patients with metastatic colorectal cancer (mCRC). This case report describes the course of treatment of a patient with metastatic colorectal cancer treated with cetuximab and irinotecan in III. line with the effect of disease stabilization. However the treatment had to be discontinued for skin toxicity and a hypersensitivity reaction. Subsequent treatment with panitumumab did not evoke an allergic reaction and brought the effect of partial remission according to the RECIST criteria.
Kolorektální karcinom (CRC) je jedním z nejčastějších nádorových onemocnění. Celosvětově představuje 4. nejčastější malignitu, v České republice je u mužů 3. nejčastějším nádorovým onemocněním hned za nádory plic a prostaty a u žen na 2. místě po karcinomu prsu (pomineme-li nádory kůže). V celosvětovém žebříčku incidence Česká republika balancuje mezi prvním a druhým místem.(1) Asi u 50 % pacientů s CRC vzniknou metastázy a nemocní na toto nádorové onemocnění umírají.
V chemoterapii CRC má dlouhodobě standardní postavení fluoropyrimidinový antimetabolit 5-fluorouracil (5-FU) a od něj odvozené deriváty, včetně perorálních forem. Nicméně fluoropyrimidiny samotné nebo v kombinaci s leukovorinem dokázaly prodloužit střední dobu přežití nemocných s mCRC jen výjimečně za hranici 12 měsíců.
Teprve zařazení dalších cytostatik, především irinotekanu a oxaliplatiny, do kombinovaných chemoterapeutických režimů s fluoropyrimidiny, prodloužilo střední dobu přežití u pacientů s metastazujícím kolorektálním karcinomem (mCRC) na 18 až 21 měsíců. Režimy FOLFIRI (5-FU + leukovorin + irinotekan) a FOLFOX (5FU + leukovorin + oxaliplatina) se na přelomu století staly standardem v léčbě 1. a 2. linie u mCRC.(2, 3)
Hlavním problémem při chemoterapeutické léčbě je neselektivita cytostatických látek a postupný rozvoj rezistence nádorových buněk. V poslední době se proto pozornost onkologů obrací k tzv. cílené biologické léčbě. U mCRC je tato pozornost zaměřena především na receptor pro epidermální růstový faktor (EGFR) a na ligand receptoru pro vaskulární endoteliální růstový faktor (VEGFR). Proti oběma uvedeným byly vyvinuty monoklonální protilátky a byla ověřena jejich účinnost v praxi.
EGFR je tyrozinkinázový receptor a u většiny pacientů s mCRC byla prokázána zvýšená exprese tohoto receptoru. Úroveň exprese EGFR u mCRC koreluje s progresí onemocnění, s rychlostí metastatického šíření a špatnou prognózou onemocnění. Aktivace EGFR vede ke zvýšenému přežívání a proliferaci nádorové buňky, k novotvorbě cév a dále podporuje migraci, invazi a v důsledku toho i metastazování. V úvodních studiích využívajících cílenou anti-EGFR léčbu byla účast omezena na pacienty s EGFR pozitivními nádory. Nemocní s vyšší expresí EGFR však nedosáhli z léčby většího prospěchu než skupiny s nižší expresí či úplně bez exprese.
Nedávné studie prokázaly mutaci genu KRAS jako zásadní faktor predikující neúspěch léčby anti-EGFR protilátkami. Tato léčba je tedy pouze účinná u onkogenu KRAS bez přítomnosti mutace, který se označuje jako „wild type“ KRAS (onkogen divokého typu).(4) Pro léčbu mCRC jsou v současné době ověřeny a schváleny dvě monoklonální protilátky, které se váží na EGFR a blokují jeho aktivaci.
První z těchto léků je cetuximab (Erbitux®). Cetuximab je IgG1 monoklonální protilátka proti EGFR. Cetuximab byl na základě výsledků klinických studií schválen již v roce 2004 americkým Úřadem pro potraviny a léky (FDA) a ve stejném roce též registrován i Evropskou lékovou agenturou (EMEA). V České republice se používá od roku 2005. Je kategorizován a zařazen do léčby pacientů s mCRC exprimujícím EGFR a vykazujícím gen KRAS divokého typu („wild type“) po selhání předchozí cytostatické léčby s oxaliplatinou a irinotekanem.
Cetuximab se podává jedenkrát týdně v úvodní nasycovací dávce 400 mg/m2 tělesného povrchu intravenózně po dobu 120 minut. Vzhledem k tomu, že cetuximab je chimérická protilátka, která se skládá z části lidské a myší, je zásadně nutná premedikace antihistaminikem a kortikoidy. Tato premedikace je doporučena při všech následných týdenních aplikacích, kdy je dávka cetuximabu snížena na 250 mg/ m2 a doba aplikace zkrácena na 60 minut. V průběhu podávání infúze a minimálně 1 hodinu po jejím ukončení je nutné pečlivé monitorování vitálních funkcí. Pokud se podává současně irinotekan, aplikuje se s časovým odstupem minimálně 1 hodiny od ukončení aplikace cetuximabu v dávce 350 mg/m2 tělesného povrchu jedenkrát za 3 týdny.(5)
Panitumumab (Vectibix®) je rekombinantní, plně humánní monoklonální protilátka IgG2, která se s vysokou afinitou a specificitou váže na lidský EGFR. Panitumumab byl schválen FDA v roce 2006 a rok později byl registrován i EMEA pro použití v Evropě. V České republice je dostupný od r. 2008. Panitumumab je v ČR nyní kategorizován pro léčbu v monoterapii u pacientů s mCRC exprimujícím EGFR a vykazujícím expresi nemutovaného („wild-type“) onkogenu KRAS, u kterých selhala léčba chemoterapautickými režimy zahrnujícími fluoropyrimidin, oxaliplatinu a irinotekan. Panitumumab se podává v dávce 6 mg/m2 intravenózně po dobu 60 minut 1krát za dva týdny. Vzhledem k tomu, že se jedná o plně humánní protilátku, není s jejím užíváním spojeno riziko tvorby protilátek proti myšímu antigenu, což významně snižuje výskyt alergických reakcí.(6) Nežádoucí účinky obou látek zahrnují kožní reakce ve formě akneformního exantému, které jsou typické pro všechny EGFR inhibitory.
Vyskytují se až u 90 % nemocných. Přítomnost kožní toxicity je však příznivým prediktorem. Vyšší stupeň této toxicity predikuje vyšší terapeutickou odpověď i delší dobu do progrese i celkové přežití. Častým nežádoucím účinkem u cetuximabu (až 10 %) jsou závažné alergické reakce, které vznikají do 1 hodiny po infúzi a projevují se rychlou obstrukcí dýchacích cest (bronchospazmus, stridor, chrapot), kopřivkou, hypotenzí až ztrátou vědomí. Pokud se objeví, vyžadují okamžité a trvalé přerušení léčby s cetuximabem.
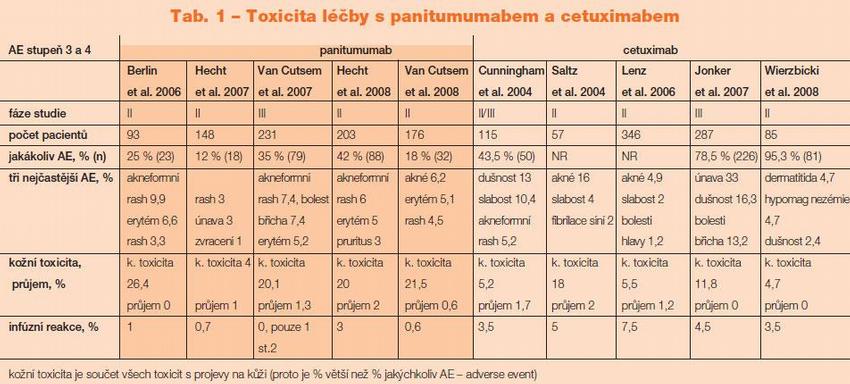
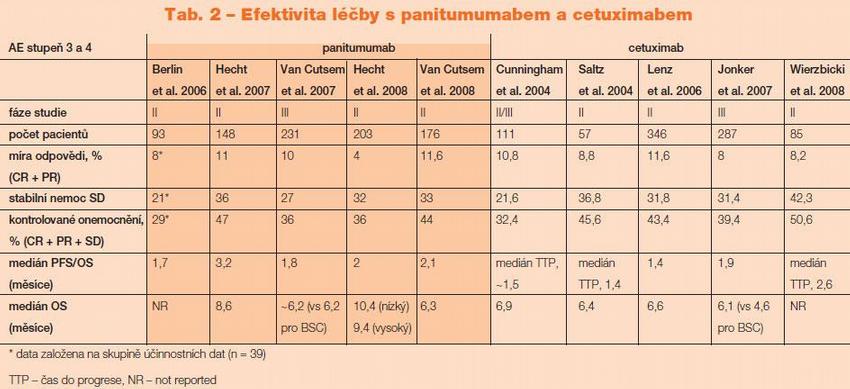
Srovnání nežádoucích účinků a efektivity léčby s cetuximabem a panitumumabem jsou uvedeny v Tab. 1 a 2.(7)
Popis vlastního případu
V září 2003 byla muži, narozenému v roce 1942, provedena na okresním pracovišti resekce sigmoidea pro adenokarcinom. Histologický nález: dobře diferencovaný adenokarcinom G1, exulcerovaný tumor, prorůstající šířkou celé stěny – pT3, vyšetřeny 4 lymfatické uzliny, ve 3 zjištěno metastatické postižení – pN1. Již předoperačně nejasný nález na USG jater. Pooperačně doplněno CT jater s nálezem 2 ložisek v dorzální části VII. segmentu jater velikosti 35x 44x 56 mm a 43x 41x 40 mm, a ve ventrokaudálním okraji VIII. segmentu další 2 ložiska velikosti 56x 28x 20 mm a 19x 17x 20 mm.
S tímto nálezem pacient přichází v říjnu 2003 na vlastní žádost k léčbě do našeho ústavu. V rodinné anamnéze bez výskytu onkologického onemocnění v rodině, v osobní anamnéze stav po CMP s pravostrannou symptomatologií v r. 1990, st. p. cévní operaci magistrálních tepen mozku l. sin v roce 1990, hypertenze kompenzována medikací, chronická bronchitida, infekční žloutenka v. s. typu A v dětství. Alergie na léky, potraviny nezjištěna. Pracoval jako sklář. Stopkuřák 13 let, kouřil 30 let 20 cigaret denně, alkohol příležitostně. Pacient klinicky v dobrém stavu, laboratorně mírná anémie, elevace tumorózních markerů: CEA 132 µg/l, CA 19–975 kU/l. Na PET vyšetření nález ložisek zvýšené metabolické aktivity v játrech v. s. neoplazie, hypermetabolismus menší aktivity zjištěn v levém hypogastriu v oblasti resekce sigmoidea: v dif. dg. reziduum, zánět, postižení lymfatických uzlin.
Pacient byl indikován k chirurgickému výkonu: dne 2. 12. 2003 provedena pravostranná hemihepatektomie. Histologicky prokázány jaterní metastázy intestinálního adenokarcinomu. Po operaci došlo k poklesu nádorových markerů k normě. Podle kontrolního CT přešetření vysloveno podezření na incipientní diseminaci do plic. V 1/2004 byla zahájena chemoterapie režimem FOLFIRI. Chemoterapie byla provázena hematologickou a gastrointestinální toxicitou, pro kterou byla dávka irinotekanu redukována o 40 %. Po 6 cyklech této chemoterapie nezjištěna nádorová diseminace. Pro opakované flebitidy po aplikaci chemoterapie zaveden i. v. port a pokračováno v další chemoterapii stejným režimem. Od 10. cyklu změněna chemoterapie na režim XELIRI pro nutnost extrakce i. v. portu pro septikémii. Při užívání Xelody dochází k výrazné slizniční toxicitě s kolapsovým stavem a neutropenii stupně (st.) 4, s nutností léčby na JIP.
Stav dále komplikován febriliemi, přetrvávajícími průjmy, následně oběhovým selháváním s plicním edémem s nutností terapie vazopresory a umělou plicní ventilací. Po zvládnutí těchto komplikací pacient dále sledován, cytostatická léčba byla ukončena. V 8/2005 dochází k recidivě onemocnění v játrech – podle MR zjištěna 2 drobná metastatická ložiska v S4 a S2. Při operační revizi v 9/2005 provedena radiofrekvenční ablace (RFA) těchto jaterních ložisek. Dále pacient sledován ambulantně, v 6/2006 podle CT v obou plicních křídlech zjištěna vícečetná drobná metastatická ložiska do 1 cm. Zahájena paliativní chemoterapie režimem XELOX s redukovanou dávkou Xelody, po 3. sérii byla chemoterapie ukončena opět pro toxicitu. Podle přešetření v 12/2006 dochází k progresi plicních ložisek cca o 40 %. Provedeno vyšetření exprese EGFR v jaterní metastáze: hodnocena jako pozitivní 2+.
Následně provedena implantace venózního portu a od 2/2007 zahájena terapie III. linie cetuximabem v kombinaci s irinotekanem. Od 4. dne po podání dochází k výsevu akneformního kožního exantému st. 2 až 3, který přetrvával po celou dobu léčby. Od 3. série musela být redukována dávka irinotekanu o 50 % pro průjem st. 3 s dehydratací. Celkem aplikováno 11 cyklů této terapie, poslední v 11/2007. Efekt léčby hodnocen každé 3 cykly, po celou dobu nález na plicích zůstává stabilizovaný. Při poslední aplikaci dochází k reakci přecitlivělosti st. 3, projevující se bronchospazmem a kožním exantémem. Poté léčba ukončena a pacient dále sledován. V období bez léčby dochází k pomalé progresi plicních metastáz. V 4/2009 nastává výrazné zhoršení námahové dušnosti, podle snímku plic se objevuje masivní metastatické postižení obou plicních křídel a na CT břicha nově solitární objemná metastáza při defektu po RFA.
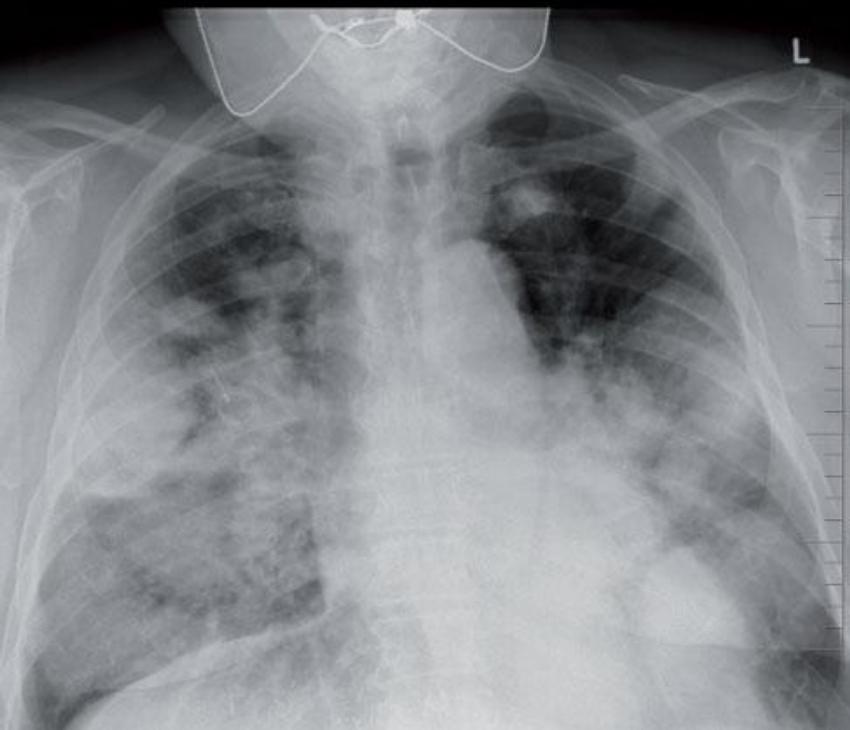
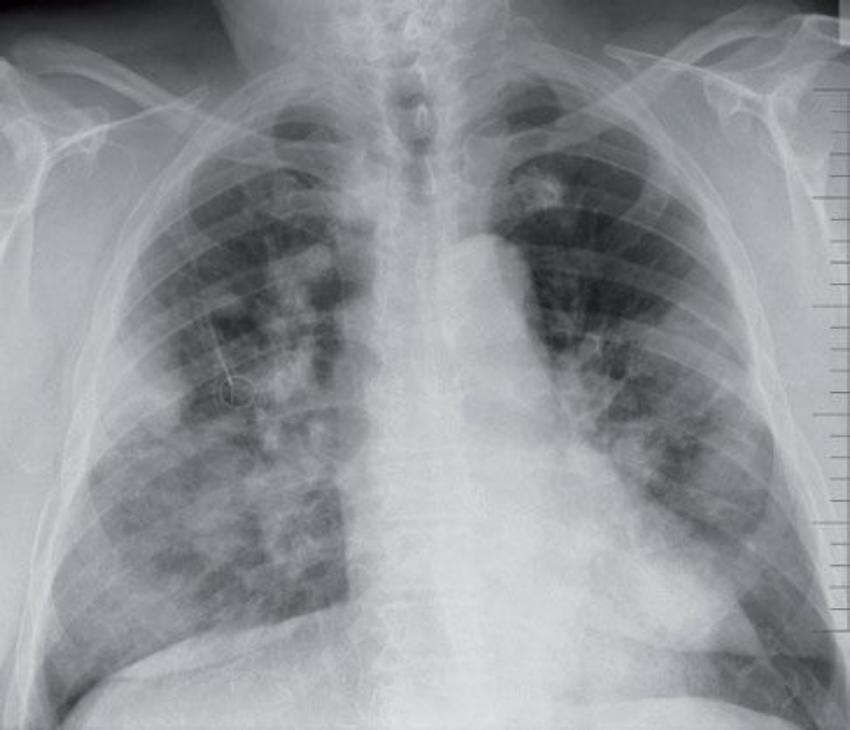
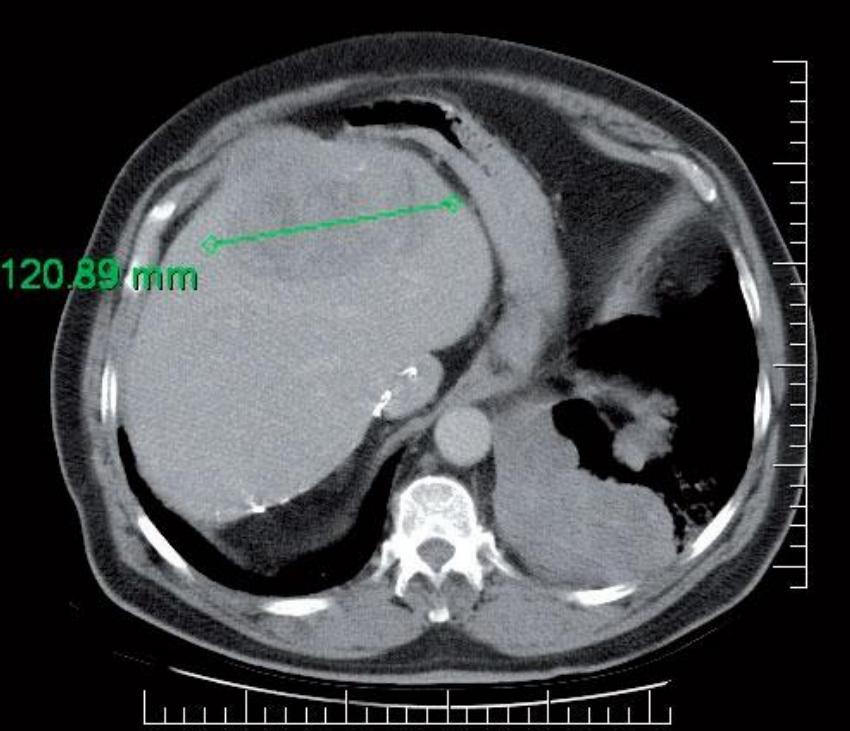
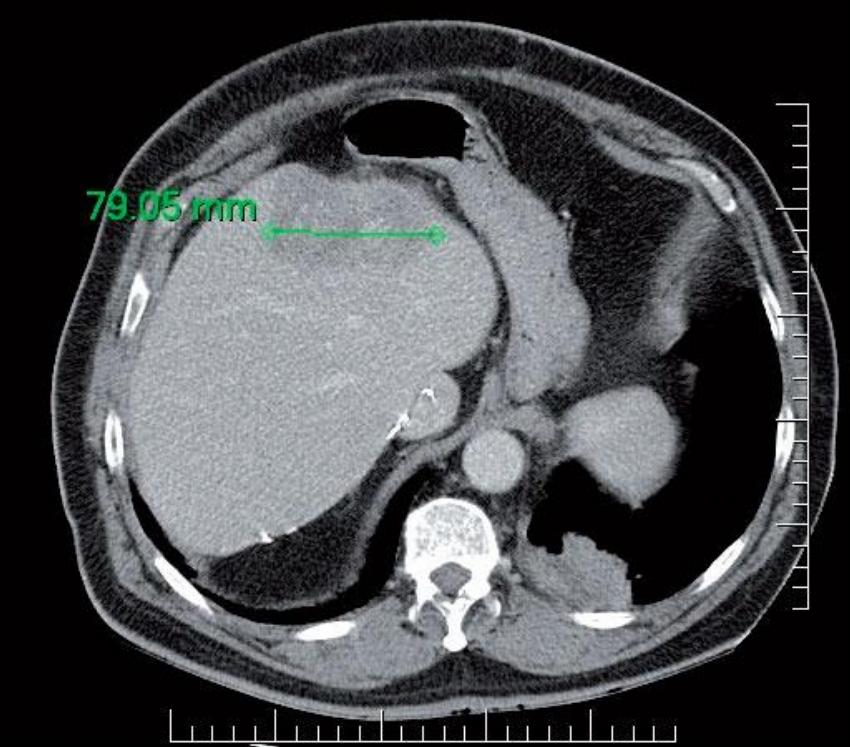
Provedeno vyšetření K-RAS: nebyla zachycena mutace genu K-RAS, jedná se o „wild type“ K-RAS. Vzhledem k tomu, že při léčbě s cetuximabem nedošlo k progresi onemocnění a tato léčba byla ukončena pro toxicitu, byla indikována biologická léčba s panitumumabem v monoterapii jako léčba IV. linie. Terapie zahájena od 6/2009. Od zahájení léčby opět dochází ke vzniku kožního akneformního exantému st. 2–3. Podle snímku plic po 4. cyklu v 8/2009 konstatována regrese metastatického postižení o více než 30 % (Obr. 2, 3), klinicky je výrazný ústup dušnosti. Rovněž ložisko jaterní podle CT s regresí o 30 % (Obr. 4, 5). Celkově aplikováno 6 cyklů do 9/2009, poté byla další aplikace odložena pro kožní toxicitu. V 10/2009 nastává postupné zhoršování stavu pacienta: dezorientace, rozvoj parézy pravé dolní končetiny a organického psychosyndromu. Podle CT potvrzeno masivní metastatické postižení mozku. Za hospitalizace zahájena plná antiedematózní terapie s pozvolnou úpravou stavu pacienta. Dále pacient předán k ošetřovatelské a rehabilitační péči podle místa bydliště. Zde v 12/2009 exitus letalis, jako bezprostřední příčina smrti uvedena bronchopneumonie.
Diskuse
U pacientů s mCRC, kteří progredují po prvních dvou liniích léčby, je efektivita další chemoterapie jen velmi nízká. Další chemoterapie navíc často přináší neúnosnou toxicitu. Před érou biologické léčby byla zpravidla v této fázi onemocnění onkologická léčba ukončena a indikována léčba symptomatická. V současné době možnost další, a to cílené léčby přináší u indikovaných pacientů významné prodloužení přežití.
Cetuximab v preklinických studiích prokázal synergický účinek při kombinaci s cytostatiky, především s irinotekanem, a dokonce i možnost překonání rezistence k chemoterapii, na kterou již nebyla při předchozí léčbě zaznamenána žádná léčebná odpověď. Tento mechanismus je vysvětlován například obnovením apoptózy, poškozením DNA-reparační aktivity či zabráněním úniku cytostatika z buňky.(8) V literatuře jsou jen velice sporadické práce, popisující zkušenosti s podáním panitumumabu u pacientů s mCRC, předléčených cetuximabem ve 3 linii léčby.(9–11) U pacienta s „wild type“ KRAS, uvedeného v kazuistice, byla efektem léčby s cetuximabem a irinotekanem stabilizace onemocnění, která trvala 10 měsíců. Léčba musela být ukončena pro toxicitu, kdy došlo k reakci přecitlivělosti po podání cetuximabu.
Rovněž výrazná kožní toxicita již začínala být pro pacienta neúnosná. V období bez léčby dochází k výrazné progresi především v plicích, což se klinicky projevuje výraznou námahovou a později i klidovou dušností. Rovněž dochází k progresi v játrech. Za této situace se rozhodujeme k podání panitumumabu. Po 4 cyklech této léčby dochází ke klinicky významnému ústupu dušnosti, což podle snímku plic potvrzuje regrese metastatického postižení o minimálně 30 %. Rovněž regreduje ložisko v játrech. Podání panitumumabu bylo pro pacienta bezpečné, i bez použití premedikace s antihistaminiky či kortikoidy se neopakovala alergická reakce. Hlavním nežádoucím účinkem byla kožní toxicita: akneformní exantém st. 3, pro kterou byla léčba po 6. cyklu přerušena.
Celkové přežití tohoto pacienta bylo 75 měsíců, což lze u pacienta ve IV. klinickém stadiu považovat za velice dobrý efekt léčby. K tomuto léčebnému výsledku jistě významně přispělo operační odstranění jaterních metastáz a při další recidivě v játrech RFA metastatických ložisek. Léčba s cetuximabem a panitumumabem byla pro nemocného méně zatěžující než předchozí chemoterapie. Ambulantní podání této léčby mělo kladný vliv na kvalitu života pacienta. Hlavní dyskomfort, se kterým se musel pacient potýkat, byla kožní toxicita.
Závěr
Naše kazuistika dokládá, že u pacienta, u kterého došlo k reakci hypersenzitivity po podání cetuximabu, byla pozdější léčba s panitumumabem zcela bezpečná, bez jakékoliv další alergické reakce. Po podání cetuximabu byla efektem léčby stabilizace onemocnění, po následné léčbě s panitumumabem dochází k parciální remisi podle RECIST kritérií. Rovněž klinický efekt této léčby byl významný. Regrese plicních metastáz vedla k ústupu dušnosti, což mělo vliv na výrazné zlepšení kvality života nemocného. Lze konstatovat, že cílená léčba s cetuximabem a panitumumabem u pacienta s mCRC bez mutace KRAS přispěla k prodloužení života a zlepšení jeho kvality.
O autorovi: MUDr. Petr Karásek
Masarykův onkologický ústav, Klinika komplexní onkologické péče
e-mail: karasek@mou.cz

