Summary
Sumerauer, D., Codl D., Grega, M., Kynčl, M., Blažek, D., Hubáček, P., Kabíčková, E., Kodet, R., Sedláček, P. Fatal course of zygomycosis in a patient treated for diffuse large B-cell NonHodgkin lymphoma
In the following report we describe a 16-years-old girl treated for agressive B-NHL who developed an invasive zygomycosis in succesion to previous Clostridium difficile enterocolitis. We document difficulties in making an early diagnosis albeit the use of molecular diagnostic methods and difficulties of treatment.
Zygomykózy jsou závažné infekce vyvolané vláknitými houbami řádu Mucorales (Mucor spp., Rhizopus spp., Absidia spp. atd.), které téměř výhradně postihují imunokompromitované pacienty. U dětí jsou hlavními rizikovými faktory zygomykózy neutropenie spojená s protinádorovou chemoterapií, nedostatečně kontrolovaný diabetes mellitus a nezralost.(1) Přestože se jedná o infekce poměrně vzácné, jejich význam u onkologických pacientů narůstá v souvislosti se zvyšující se intenzitou používané protinádorové léčby, selekčním tlakem používaných antimykotik i regionální situací v rámci jednotlivých hematoonkologických center.(2)
V případě invazívních infekcí vyvolaných zygomycetami je navíc v popředí velmi vysoká mortalita onemocnění, při poměrně omezených léčebných možnostech. Vysoká mortalita je podmíněna invazivitou houby, obtížně dosažitelnou časnou diagnostikou a poměrně nízkou aktivitou dostupných antimykotik proti zástupcům řádu Mucorales.(3)
Popis případu
Šestnáctiletá pacientka byla přijata na Kliniku dětské hematologie a onkologie FN Motol k objasnění pancytopenie v krevním obraze odebraném po respiračním infektu se subfebriliemi. V době stanovení diagnózy jsme v krevním obraze potvrdili pancytopenii, hypogamaglobulinémii a v somatickém nálezu zjistili významnou splenomegalii a hraničně zvětšené lymfatické uzliny na krku. Trepanobiopsie kostní dřeně prokázala masívní infiltraci dřeně maligním lymfomem charakteru difúzního velkobuněčného B-NHL (DLBCL – diffuse large B-cell lymphoma). Diagnózu jsme potvrdili i histopatologickým vyšetřením exstirpované zvětšené lymfatické uzliny (LU) vlevo na krku.
Vstupní staging včetně PET/CT potvrdil pokročilý nález onemocnění s postižením LU krku, jater, sleziny a kostní dřeně, klinického stadia IV. podle St. Jude klasifikace.(4) U dívky jsme indikovali standardní chemoterapii podle protokolu BFM B-NHL 04. Po kortikoidové předfázi pacientka absolvovala tři bloky intenzívní chemoterapie, následované vždy nekomplikovanou febrilní neutropenií při krátké granulocytopenii. Antimykotická profylaxe nebyla prováděna, krátkodobě při febrilní neutropenii pacientka užívala flukonazol. Čtvrtý blok chemoterapie s vysokodávkovaným metotrexátem absolvovala bez komplikací (blok AA24 – dexametazon 10 mg/m2/den 1–5; vinkristin 1,5 mg/m2/den 1; metotrexát 5 g/m2/24 hodin den 1; cytarabin 2x 150 mg/m2/den 4 a 5; etoposid 100 mg/m2/den 4 a 5, ifosfamid 800 mg/m2/den 1–5, intratékální triplet).
Pátý den po dokončení bloku chemoterapie jsme pacientku hospitalizovali pro mukozitidu v dutině ústní a nízký perorální příjem. Při přijetí jsme v krevním obraze zjistili již plně rozvinutou pancytopenii po chemoterapii (leu 0,2x 109/l, ery 2,28x 1012/l, hb 71 g/l, hct 0,198, tr 20x 109/l), teploty dívka dosud neměla a rovněž parametry zánětu byly nízké (CRP 7,9 mg/l). Pro hraniční hydrataci pacientky jsme zahájili infúzní léčbu, korigovali jsme anémii a trombocytopenii. Od 2. dne hospitalizace se objevily horečky, zahájili jsme antibiotickou terapii v kombinaci piperacilin/tazobaktam, amikacin, pro bolestivou mukozitidu analgetickou terapii a částečnou parenterální výživu.
Současně s horečkami se objevily opakované řídké průjmovité stolice bez patologické příměsi, postupně s narůstajícími křečovitými bolestmi břicha, distenzí dutiny břišní a retencí tekutin. Klinicky i sonograficky byly zřetelné známky neutropenické enterokolitidy s následným kultivačním průkazem Clostridium difficile s produkcí toxinu. Podle klinického obrazu jsme již od první manifestace průjmů, před průkazem klostridiové enterokolitidy, k antibiotické terapii přidali i perorální metronidazol. Pro trvající horečky, gastrointestinální obtíže a vzestup CRP jsme postupně antibiotickou terapii upravili na kombinaci meropenem, amikacin, teicoplanin, metronidazol a flukonazol.
Během uvedené terapie se klinický stav pacientky postupně zlepšil. Horečky poklesly a snížila se frekvence stolic. V krevním obraze však nadále trvala granulocytopenie. Jedenáctý den hospitalizace jsme při afebrilním průběhu dokumentovali vzestup CRP (109..178 mg/l), nově se objevily také hyposaturace s nutností oxygenoterapie polomaskou. Opět progredovala distenze dutiny břišní i přes vysokou podporu diurézy. Vzhledem k uvedenému průběhu jsme zahájili terapii lipidovým komplexem amfotericinu B (Abelcet). Již následujícího dne pacientka regeneruje krvetvorbu (ANC > 500) a proto vysazujeme G-CSF (faktor stimulující kolonie granulocytů).
Hemokultury i sérologie mykóz (manan a galaktomanan) jsou opakovaně negativní, klinický stav pacientky se zlepšuje. Granulopoéza je plně obnovena, diuréza s podporou furosemidem je dostatečná. Dosahujeme negativní bilance tekutin, regreduje distenze dutiny břišní, sonografický nález v oblasti dutiny břišní se upravuje. Rtg vyšetření hrudníku prokazuje ústup intersticiálních plicních změn. Zánětlivé parametry poklesly, ale trvaly teploty kolem 38 st. C. Po týdnu další terapie redukujeme antibiotickou léčbu, aplikaci Abelcetu ukončujeme po 8 dnech. Pacientku převádíme na itrakonazol. Kontrolní hemokultury, kultivační vyšetření i sérologie jsou nadále negativní, rtg hrudníku je dále zlepšen.
Echokardiografické vyšetření prokazuje jen nevýznamný perikardiální výpotek. Při dobrém celkovém stavu pacientky zvažujeme pokračování léčby (rituximab), ale 4. den (22. den hospitalizace) po ukončení aplikace Abelcetu je pacientka opět febrilní, výrazně klidově dušná, vyžaduje oxygenoterapii polomaskou. V krevním obraze zjišťujeme hyperleukocytózu (115x 109/l), v laboratoři vzestup prokalcitoninu (0,49..18,9 µg/l) a vzestup CRP (105..353 mg/l). Předpokládáme katétrovou infekci, po odběru hemokultur uzavíráme katétr, upravujeme ATB terapii (cefepim, amikin, vankomycin, Abelcet). Podáváme bolus kortikosteroidů. Pacientku stabilizujeme, poslechově zjišťujeme oslabené dýchání vpravo bazálně, prokazujeme fluidothorax l. dx.
Pro progredující respirační insuficienci pacientku předáváme na anesteziologicko-resuscitační kliniku (ARK). Na ARK je dívka intubována, je zahájena umělá plicní ventilace. Dívka je postupně invazívně zajištěna. Pro oběhovou nestabilitu je nutná inotropní podpora noradrenalinem a dobutaminem. Odstraňujeme tunelizovaný Broviacův katétr, doplňujeme CT hrudníku a břicha s nálezem masivního fluidopneumothoraxu vpravo s kolapsem pravé plíce a výrazné splenomegalie s mapovitými ložisky, která se postkontrastně sytí (Obr. 1).
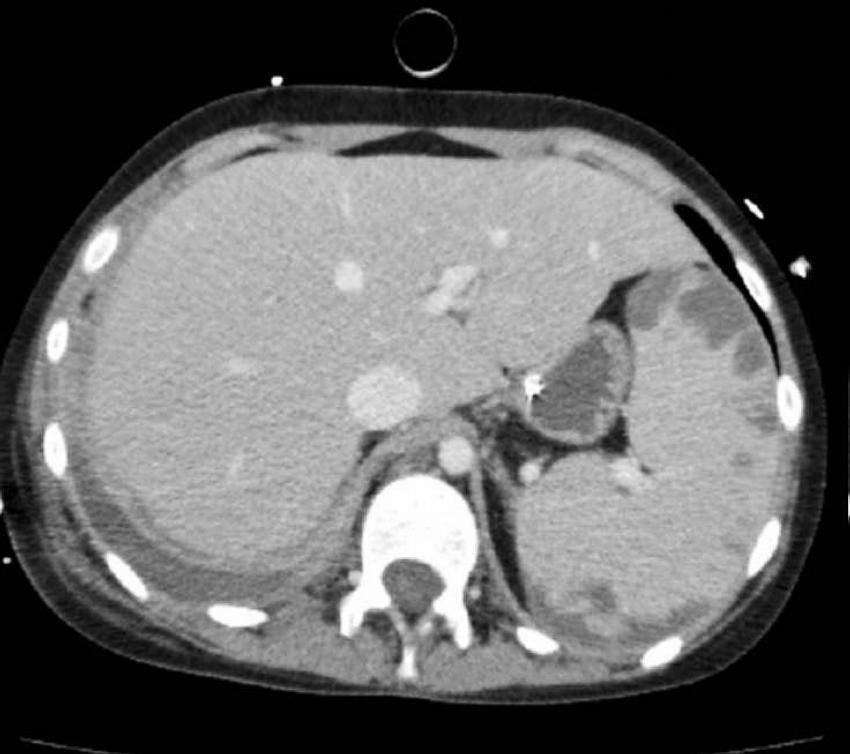
Přestože CT hrudníku v přehledném plicním parenchymu neprokazuje ložiskové postižení, předpokládáme invazívní mykózu. U pacientky zavádíme hrudní drenáž, která odvedla 1200 ml hnědočerného výpotku z pravé pohrudniční dutiny. Z výpotku jsou z mikroskopického vyšetření překvapivě hlášeny kvasinkové mikroorganismy, a proto antimykotickou medikaci upravujeme na kombinaci Abelcet, kaspofungin. Na terapii je pacientka stabilní, ale 5. den hospitalizace na ARK dochází k náhlému masívnímu krvácení z dutiny ústní. Zdroj krvácení se vzhledem k masivnosti krvácení nedaří lokalizovat, od počátku krvácení provází hypotenze, bradykardie až elektromechanická disociace. Přes razantní opatření krvácení neustává, nedaří se udržet adekvátní krevní oběh a pacientka umírá pod obrazem refrakterního šoku.
V hemokultuře odebrané před uzavřením tunelizovaného katétru ještě na hematoonkologickém oddělení kultivačně prokazujeme Saccharomyces cerevisiae, kvasinku prokazujeme kultivačně i ve výpotku pravé pohrudniční dutiny. Ve výpotku však kultivačně prokazujeme ještě vláknitou houbu později dodatečně určenou jako Rhizopus microsporus var. rhizopodiformis. Výpotek je též silně pozitivní při PCR detekci zygomycet. Histopatologicky v sekčním materiálu potvrzujeme generalizovanou zygomykózu v pohrudniční dutině a masivní mykotickou arteriitidu sestupného oblouku aorty (Obr. 2, 3) a invazi přilehlého perikardu. Pomocí zygomycetes specifické PCR detekujeme silnou pozitivitu ve vzorcích odebraných ze srdce, ulcerace aorty descendens (Obr. 4), z oblasti ilea a pravé plíce.
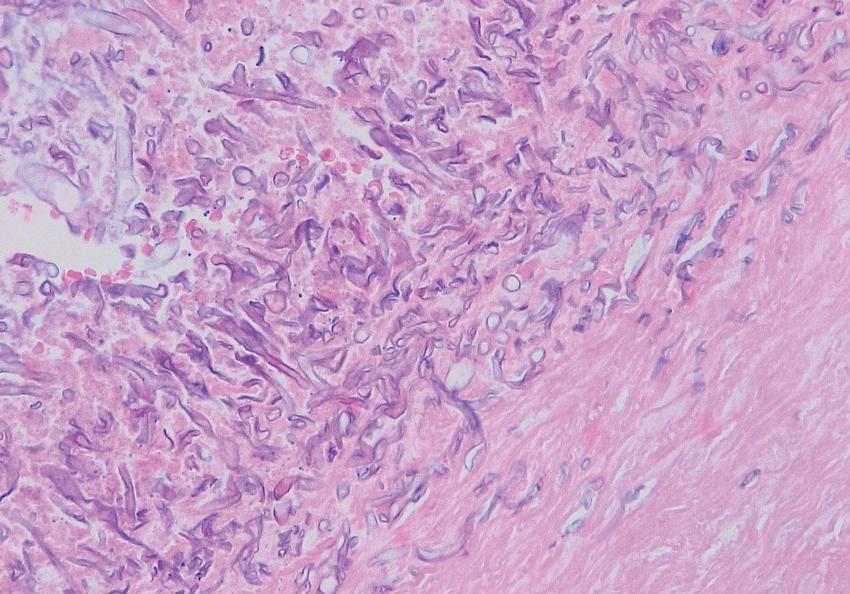
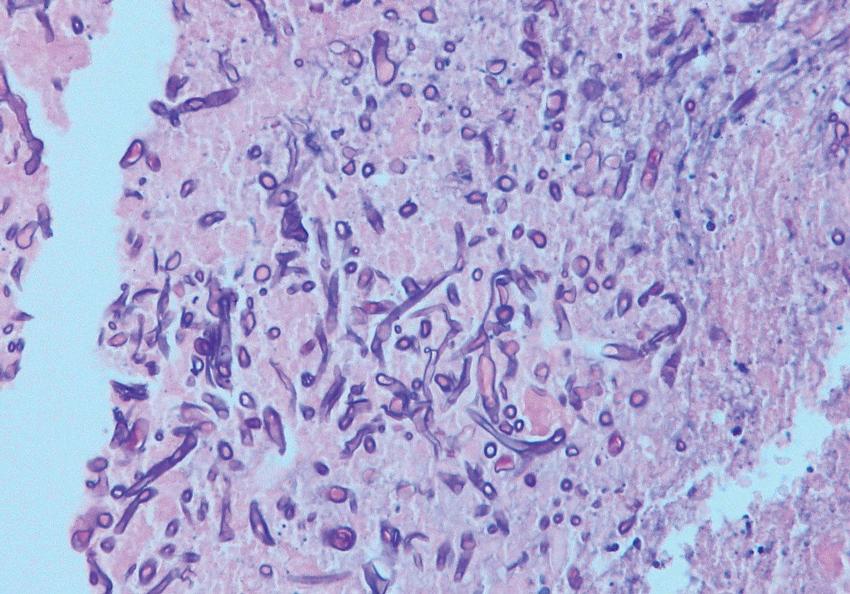
PCR nález je plně ve shodě s histopatologickým nálezem z jednotlivých orgánů. Přítomnost zygomycet metodou PCR prokazujeme i ve vzorku séra odebraného před překladem pacientky na ARK. V nekrotických ložiscích ve slezině jsme zygomykózu neprokázali, zdroj masívního krvácení z dutiny ústní nebyl při pitvě identifikován.
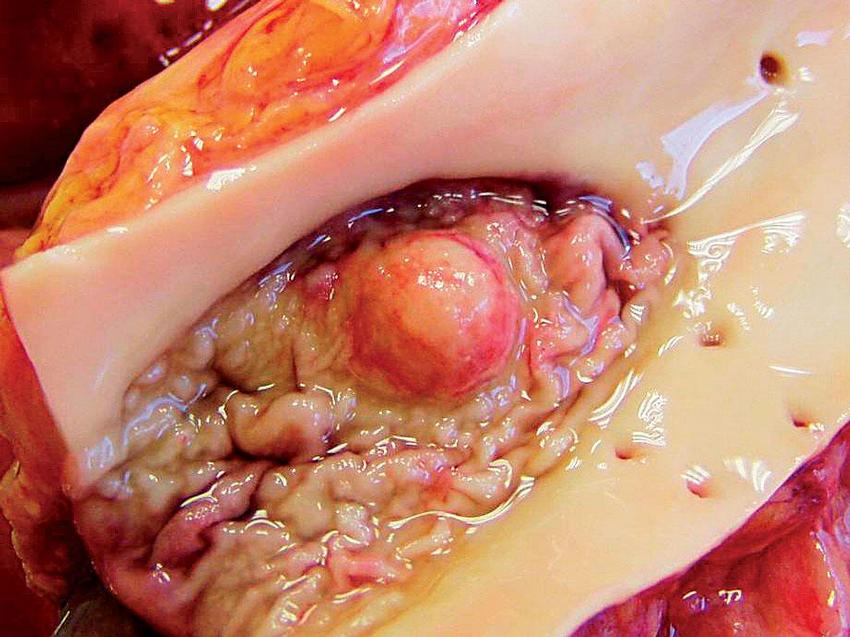
Zygomykóza je jednou z nejobávanějších oportunních plísňových infekcí s agresívním průběhem a vysokou mortalitou. Pacienti s hematologickou malignitou, případně po SCT, nejčastěji onemocní rinocerebrální, plicní nebo diseminovanou formou. Echinokandiny ani azoly s výjimkou posakonazolu nemají klinicky relevantní účinnost proti zástupcům řádu Mucorales.(3) V terapii je třeba vždy zvážit možnost radikálního odstranění ložisek zygomykózy, což u části hematoonkologických pacientů vzhledem k závažnému celkovému stavu není vždy možné. Lékem první volby zůstávají deriváty amfotericinu B, především lipidové preparáty vzhledem k nižší toxicitě při potřebném dlouhodobém podávání maximálně tolerovaných dávek.(3)
Posakonazol v dávkách 800 mg/den má jako jediný z azolů dobrou účinnost na většinu izolátů zygomycet in vitro a může být účinný v terapii i v případě selhání primární léčby.(5) Přesto, především u pacienkazuistikytů s omezeným vstřebáváním perorálně podávaného léku (mukozitida, gastrointestinální forma GVHD, enterokolitida), nejsou dosahované MIC v séru často postačující. Je nutné sledování plazmatických koncentrací posakonazolu s případnou úpravou dávkování a způsobu užití léku, který je podáván vždy s jídlem.(6) Řada recentních experimentálních prací významně zpochybňuje uváděnou účinnost posakonazolu proti zygomycetám v myším modelu.(3)
Monoterapii posakonazolem jako léčbu první volby není proto možné doporučit. Pro kombinovanou antimykotickou léčbu zygomykózy nemáme v současné době dostatek informací, retrospektivní analýzy a kazuistická sdělení naznačují lepší výsledky léčby v případě kombinace lipidové formy amfotericinu B a kaspofunginu u rinocerebrální zygomykózy.(7) Synergistické působení této kombinace antimykotik podporují i některé modely diseminované zygomykózy.(8) U námi léčené dívky jsme zvažovali invazívní mykózu při dramatickém klinickém zhoršení pacientky s plně obnovenou krvetvorbou.
Opakovaná negativita mananu a galaktomananu v séru také podporovala možný záchyt zygomykózy. K terapii Abelcetem jsme se vrátili po třech dnech přerušení, které při dlouhém poločasu léčiva v tkáních mělo pravděpodobně jen malý dopad na celkový průběh onemocnění. Pozdějším stanovením MIC u izolátu houby (Rhizopus microsporus var. rhizopodiformis) jsme navíc zjistili jen omezenou fungicidní aktivitu amfotericinu B, žádný z izolátů, tedy ani Saccharomyces cereviciae, nebyl citlivý k přechodně podávanému itrakonazolu.
Kombinace Abelcetu s kaspofunginem, kterou jsme použili po zjištění přítomnosti kvasinek ve výpotku, nepřinesla klinický benefit a zygomykózu bohužel neovlivnila. Nezodpovězenou otázkou zůstává zdroj infekce. Vzhledem k předchozí neutropenické enterokolitidě, PCR průkazu zygomykózy ve střevě a současné infekci podmíněně patogenní kvasinkou Saccharomyces cerevisiae předpokládáme spíše alimentární cestu nákazy, kterou podporuje užívání probiotik a nejasných doplňků stravy pacientkou.(9)
Podpořeno výzkumným záměrem FN Motol 0000064203 a grantem IGA NS/9997-4.
O autorovi: 1MUDr. David Sumerauer, Ph. D., 2Ing. Daniel Codl, Ph. D., 3MUDr. Marek Grega, 4MUDr. Martin Kynčl, 5MUDr. Daniel Blažek, 1MUDr. Petr Hubáček, Ph. D., 1MUDr. Edita Kabíčková, 3prof. MUDr. Roman Kodet, CSc., 1doc. MUDr. Petr Sedláček, CSc.
1Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice v Motole, Klinika dětské hematologie a onkologie
2Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice v Motole, Ústav lékařské mikrobiologie
3Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice v Motole, Ústav patologie a molekulární medicíny
4Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice v Motole, Klinika zobrazovacích metod
5Univerzita Karlova v Praze, 2. lékařská fakulta a Fakultní nemocnice v Motole, Klinika anesteziologie a resuscitace
e-mail: david.sumerauer@fnmotol.cz

