Souhrn
Souborný článek se věnuje intoxikacím vzniklým uštknutím jedovatými exotickými hady i zmijí obecnou Vipera berus, následky kousnutí pavouky Araneida, tropickými stonožkami Chilopodes, poranění jedovatými rybami, štíry Scorpiones a blanokřídlým hmyzem Hymenoptera. Jsou popsány jednotlivé typy jedů a toxinů, diagnostika a odhad závažnosti stavu, klinické projevy intoxikací, komplikací a možnosti terapie.
Summary
Valenta, J. Clinical toxinology of injuries caused by venomous animals
Envenoming after injury caused by venomous snakes and other venomous animals in Central Europe stays in terms of low incidence on the edge of professional interest, and the medical community is usually not sufficiently informed about its clinical status and treatment. However, about several dozen cases occur in the Czech Republic annually, and some of them may lead to serious health impairment or death risk. This comprehensive article deals with envenoming resulting from exotic venomous snakes and vipers of Vipera berus species bites, consequences of bites by Araneida spiders, tropical millipede Chilopodes, injuries caused by venomous fish, Scorpiones scorpions and Hymenoptera hymenopteral insects. Individual types of venoms and toxins, diagnostics and estimation of condition severity, clinical manifestations of envenoming complications and treatment options are described.
Uštknutí jedovatým hadem
Intoxikace při uštknutí exotickými jedovatými hady hrozí při jejich chovatelství, častěji amatérském, ale i profesionálním. Léčba následné intoxikace vyžaduje alespoň hrubou orientaci v toxinové výbavě hada, rychlosti nástupu účinku jednotlivých toxinů, možném rozvoji a vývoji postižení, stupni ohrožení pacienta. Hlubší znalosti jsou pak nutné k případnému urgentnímu zajištění a následné terapii intoxikovaného pacienta.
Jedový aparát hadů
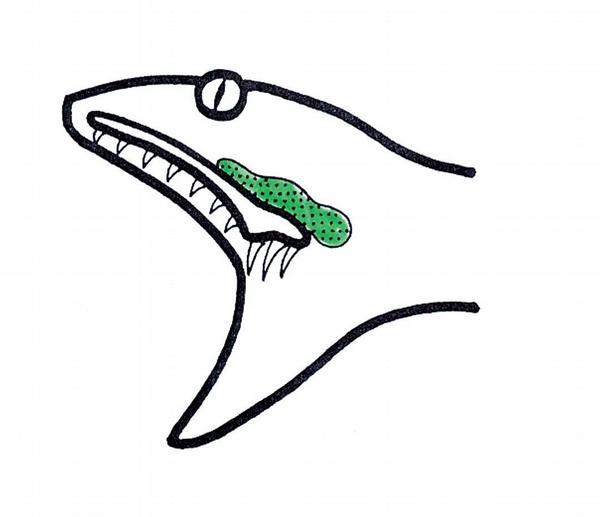
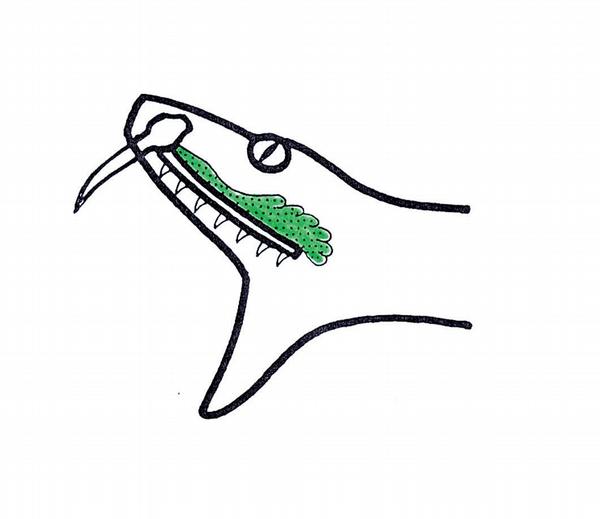
Podle anatomické stavby jedového aparátu dělíme jedovaté hady do tří skupin. Nejprimitivnější jedový aparát je vyvinut u skupiny opistoglypha. V zadní části horní čelisti jsou umístěny prodloužené rýhované zuby, tzv. zadní jedové zuby, které zprostředkují aplikaci malého množství často účinného toxinu (Obr. 1). Zástupci jsou jedovaté užovky, např. bojgy, jihoevropský šírohlavec Malpolon a další. Do skupiny proteroglypha řadíme hady s malými fixně umístěnými zuby v přední části horní čelisti (Obr. 2). Patří sem hadi korálovcovití, mimo jiné kobry a mamby, jedovatí hadi austropapuánští a mořští. Nejvyvinutější jedový aparát mají hadi skupiny solenoglypha. Až 4 cm dlouhé, při otevření tlamy vztyčitelné jedové zuby s kanálkem jsou umístěny na přední části horní čelisti (Obr. 3). Do skupiny jsou řazeni hadi zmijovití: zmije, chřestýši, chřestýšovci a další.
Anatomické rozdíly stavby jedového aparátu nesou s sebou jisté odlišnosti při možném vzniku intoxikace po kousnutí. U opistoglyfních užovek je možnost obranného zákusu ztížena pozicí jedových zubů; krom složení jedu z tohoto pohledu patří kousnutí bojgou africkou Dispholidus typus k postižením vážným, intoxikace je pravděpodobnější, protože jedové zuby jsou umístěny blíže středu maxily. Proteroglyfní hadi mají drobnější jedové zuby, množství aplikovaného jedu při zákusu zvyšují tzv. žvýkáním.
Při rychlém odtržení hada se tak snižuje možnost závažné intoxikace, nicméně na tento fenomén nelze klinicky spoléhat. Mořští jedovatí hadi mají většinou drobné jedové zuby, které nejsou schopny prokousnout potápěčský oblek, ve valné většině se o to nesnaží, i když se často k potápěčům přidruží. Hadi solenoglyfní regulují volně jak erekci svých jedových zubů, tak množství jedu aplikovaného z jedové žlázy. Mnohdy nejdříve simulují výpad bez vztyčení zubů nebo při obranném kousnutí nevypustí jed (tzv. dry bite). Z anatomie jedových aparátů i klinické praxe vyplývá, že ne všechna kousnutí jedovatým hadem znamenají nutně intoxikaci. Zhruba 50 % kousnutí proběhne bez závažnější intoxikace, nebo jen s postižením lokálním.(1, 2, 3)
Hadí jedy a intoxikace
Hadí jedy jsou multikomponentální směsi biologicky aktivních složek oligo- až polypeptidické a polysacharidové povahy, nízkomolekulárních látek a iontů. Jedovaté složky je možno dělit na neenzymatické toxiny velikosti 3–30 kD, které mají většinou specifický účinek na systém nebo tkáň, a toxické enzymy, např. proteázy, hyaluronidázy, esterázy apod. velikosti větší než 30 kD, které mají většinou nespecifický účinek na libovolnou tkáň. Složení jedů je variabilní druhově v rodu, ontogeneticky i teritoriálně. Z klinického pohledu dělíme nejčastěji toxické složky podle účinků na systémy a orgány.(2, 3) Neurotoxické složky Neurotoxiny ovlivňují nervový systém, nejčastěji periferní motorické, ale i vegetativní a senzitivní nervy.

Neurotoxiny alfa (α) způsobují svalovou paralýzu postsynaptickou blokádou neuromuskulárních synapsí. Reverzibilně kompetitivně inhibují acytylcholin na alfa (?) podjednotce receptorů neuromuskulární ploténky s následkem kurareformní paralýzy kosterního svalstva postupující kraniokaudálně. Rychle se vstřebávají, příznaky jsou zaznamenány během minut. Postižení začíná ptózou, oftalmoplegií, faciální obrnou, dysfagií a dále vede až k paralýze dýchacích svalů. Smrt udušením může nastat do 30 minut. Jsou komponentami jedu korálovcovitých hadů (např. asijské kobry, mamby), hadů austropapuánských (např. tajpan, pakobra), mořských (vodnáři a vlnožilové), v mírné formě některých jedovatých užovek (bojga).
Svalová paralýza vyžaduje zajištění dýchacích cest pro dysfagii a poruchy kašle, kde hrozí aspirace žaludečního obsahu, při paralýze dýchacího svalstva je nutná umělá plicní ventilace. Paralýza je většinou reverzibilní v čase. Testem na působení neurotoxinů alfa (?) je zlepšení svalové slabosti po podání krátce působícího inhibitoru acetylcolinesterázy edrofonia (není u nás k dispozici) nebo neostigminu (0,5 mg i. v.). Je-li testovací dávka účinná, je možno podpořit terapii neostigminem 0,5 mg po 20 min a premedikaci atropinem. Není-li kontraindikace, je při klinických projevech indikováno podání antiséra.(2, 3, 4)
Neurotoxiny beta (ß) jsou typem neurotoxických složek. Působí presynapticky, jsou enzymatické povahy: fosfolipázy A2 (PLA2) s afinitou k nervové tkáni. Způsobují poruchy uvolňování, transmise nebo destrukci acetylcholinu na neuromuskulární ploténce a dalších neuronálních spojích. Tím vyvolají chabou paralýzu nebo svalové fascikulace (fascikuliny – inhibují acetylcholinesterázu a zvyšují koncentraci dostupného acetylcholinu).
Většinou mají nižší účinek, poškození však nemusí být plně reverzibilní. Projevy postižení jsou, krom působení fascikulinů, klinicky méně závažné a nezpůsobují těžší svalovou paralýzu. Jsou obsaženy v jedech některých austropapuánských terestrických hadů, zmije řetízkové Daboia russelli, chřestýše brazilského Crotalus durissus, také spolu s neurotoxinem alfa (?) v jedu mamby a bungara.
Léčba mírných poruch není nutná, při těžších projevech je vhodné podat včas antisérum. Podání inhibitoru acetylcholinesterázy je kontraindikováno; omezilo by se odbourávání vysoké hladiny acetylcholinu.(2, 4, 5)
Kardiovaskulárně účinné složky
Skupinu složek tvoří různorodé látky působící na cévní systém v převážné většině vazodilatačně, vzácně vazokonstrikčně. Dále jedy obsahují specifické kardiotoxiny působící na srdeční činnost: frekvenci, rytmus, kontraktilitu myokardu a srdeční výdej.
Vazodilatační složky působí primárním ovlivněním tonusu cévní stěny nebo jako kinin-releasing enzymy. Klinickým příznakem je hypotenze, oběhový kolaps až šok. Stav je potencován extravazací a krvácením, hrozí renální selhání. Jsou obsaženy hlavně v jedech zmijí a chřestýšů.
Léčba je primárně symptomatická: volumoterapie, katecholaminy. Při protrahovaných, kombinovaných nebo težších příznacích je indikováno podání antiséra.(2, 3)
Vazokonstrikční složky – sarafotoxiny působí vazokonstrikci až spazmus cév včetně aa. coronariae. Příznaky intoxikace jsou hypertenze, přechodné zvýšení kontraktility a srdečního výdeje, ischémie myokardu, převodní poruchy. Sarafotoxiny jsou součástí jedu zemězmijovitých hadů Atractaspididae.
Terapie je symptomatická, je možno podat nitráty, antisérum není k dispozici. Existuje částečně zkřížená imunita se složkami antiséra SAIMR Afrika.(2, 6)
Kardiotoxiny ovlivňují specificky myokard a převodní systém, působí poruchy kontraktility nebo rytmu. Jsou součástí jedů zmije gabunské Bitis gabonica, zmije nosorohé Bitis nasicornis, kobry monoklové Naja kaouthia a dalších. Příznaky jsou poruchy kontraktility, srdečního rytmu a snížení srdečního výdeje.
Terapie je symptomatická včetně volumoterapie, podle potřeby alfa (?) a beta (ß) sympatomimetika, nelze vyloučit potřebu přechodné kardiostimulace. Podání antiséra je indikováno časně po vzniku příznaků.(2, 3)
Hemoraginy
Hemoraginy jsou enzymatické složky, většinou metaloproteázy. Způsobují porušení integrity cévní stěny a kapilár poškozením endotelu i subendotelia. Sekundárně aktivují hemokoagulační systém. Způsobují různé typy lokálních kožních a tkáňových hemoragií, otoky, extravazaci, hypotenzi, renální selhání a potencují systémové krvácení. Složky jsou obsaženy převážně v jedech zmijí, zemězmijí, austropapuánských terestrických hadů (dříve tajpanovitých), některých kober a dalších. Lokální postižení nevyžaduje zvláštní přístup. Vhodná je šetrnost, drenážní poloha končetiny, analgetika a ošetřování postižených míst. Při systémové intoxikaci je základem symptomatická terapie: volumoterapie při hypotenzi, možném renálního selhání a oxygenoterapie, vzácně až umělá plicní ventilace při postižení plic. Při vzniku systémových příznaků je vhodné včasné podání antiséra.(2, 3, 4)
Hemokoagulačně aktivní složky
Hemokoagulaci ovlivňující složky působí na plazmatický koagulační systém (aktivují systém včetně protrombinu a kontaktní cesty s následkem konzumpce), aktivitu inhibitorů (degradují inhibitory trombinu, aktivují protein C), fibrinogen (trombin-like fibrinogen konverzní enzymy, složky degradující fibrinogen a fibrin), krevní destičky a endotel. Nástup účinku trvá hodiny až desítky hodin, projevy mají pozdní charakter a vysoký podíl na morbiditě a mortalitě. Intoxikace se projevuje patologií v laboratorních nálezech, krvácením a trombotickými komplikacemi.
Jsou podstatnou součástí jedů některých zmijí (Echis, Daboia), křovinářů (Bothrops), chřestýšů a chřestýšovců (Crotalus, Trimeresurus), užovek (Boiginae), austropapuámských terestrických hadů (tajpan, pakobra) a některých kober.
Laboratorní příznaky intoxikace bývají patrné za 4–24 hodin. Nejčastěji dochází k prodloužení koagulačních časů, snížení hladiny fibrinogenu, trombocytopenii, zvýšení fibrin degradačních produktů (FDP) a D dimerů; snížení aktivity antitrombinu (AT) nemusí být ani při konzumpční poruše patrné, složky jedu aktivující koagulační systém nebývají AT inhibovatelné.
Klinicky se projeví krvácením (hematurie, rány, GIT, mozek…), (mikro)trombotizacemi (plicní řečiště, splanchnikus…) a renálním selháváním.
Terapie je v prvé řadě symptomatická, spočívá v podání čerstvě mražené plazmy, výjimečně fibrinogenu a AT, mimo stavy krvácení v podání heparinu. Antisérum je indikováno, často opakovaně již při těžších laboratorních změnách.(2, 3, 5, 7)
Myotoxiny
Myotoxiny jsou specifické neenzymatické toxiny nebo enzymy způsobující rabdomyolýzu, myonekrózy, myoglobinurii, renální selhání a v místě uštknutí často kompartmentový syndrom.
Zástupci hadů disponující jedem s myotoxickými vlastnostmi jsou některé zmije (Daboia sp.), někteří korálovcovití Elapinae (kobry Naja, mořští hadi Enhydrina, terestričtí austropapuánští hadi tajpan Oxyuranus, pakobra Notechis), chřestýši (Crotalus sp., Bothrops sp.) a další.
Příznaky jsou laboratorní nález zvýšeného myoglobinu, kreatinkinázy (CK), kalia (K) v séru. Klinicky pak svalová bolest lokálně a generalizovaně a většinou zřetelná myoglobinurie. Je nebezpečí vzniku kompartmentového syndromu a renálního selhání.
Symptomatická terapie není, vývoj je možno zvrátit pouze antisérem. Prevencí renálního selhání je vyšší objemová nálož; je nutná kontrola a korekce hyperkalémie. Léčba kompartmentového syndromu (kompartmentový tlak vyšší než 45 mmHg, 6 kPa) – drenážní poloha končetiny, manitol 0,5–2 g/kg, opakování antiséra, hrozí-li zástava perfúze, fasciotomie. Ta se však nikdy neprovádí preventivně.(2, 8, 9)
Nefrotoxicky účinné složky
Protože nebyly zatím spolehlivě izolovány specificky nefrotoxické složky jedů, uvažuje se, že poškození renálních funkcí je způsobeno sekundárně působícími složkami s jinou specifitou a lokálně toxickými enzymy: myoglobinem destruovaných svalů, snížením i. v. náplně extravazací, poškozením endotelu kapilární sítě glomerulů, obstrukcí glomerulárního průtoku mikrotromby, kontaktem toxických enzymů s endotelem glomerulů a tubulární výstelkou a dalšími vlivy.
Nejčastěji vzniká renální insuficience při intoxikaci jedem zmijí, chřestýšů a mořských hadů Hydrophiinae, často je však výsledkem ne zcela adekvátní terapie nebo podcenění preventivní ochrany ledvin. Alarmujícími nálezy jsou: myoglobinurie, hemoglobinurie, zvýšení sérových hodnot hemoglobinu, myoglobinu, CK a K, hypotenze, velké otoky, hypovolémie, aktivace hemokoagulačního systému typu diseminované intravaskulární koagulace (DIC) s přítomnosti vysokých hladin FDP (D dimerů).
Prevence spočívá v doplnění nebo zvýšení i. v. objemu, udržení dostatečných perfúzních tlaků, podání diuretika – furosemidu a korekci aktivace koagulace (glomerulární mikrotrombózy). Při vzniku oligurického renálního selhání je nutno použít hemofiltraci nebo hemodialýzu (continuous renal replacement therapy – CRRT). Trombofilie při aktivaci hemokoagulace způsobuje při metodách CRRT obtíže častými trombotizacemi okruhu přístroje. Renální selhání bývá až na výjimky při vhodné terapii reverzibilní. Těžkou trombofilii lze řešit podáním vhodného antiséra, na průběh již vzniklého renálního selhání antisérum patrně vliv nemá. Nicméně při výskytu výše uvedených těžkých laboratorních nebo klinických nálezů je podání antiséra indikováno.(2, 3)
Složky s lokálním účinkem
Jde o látky převážně enzymatické povahy, které mají nespecifický destrukční charakter. Působí proti bílkovinám (proteázy, endopeptidázy, exopeptidázy), tukům (lipázy, fosfolipázy), polysacharidům, mukopolysacharidům (hyaluronidázy, elastázy), nukleovým kyselinám (nukleotidázy). Dále do této funkční skupiny patří složky toxinového typu: myotoxiny a obecně nekrotizující toxiny.
Nositeli těchto složek jsou především zástupci zmijí (Bitis sp., Daboia russelli, Echis sp., Macrovipera sp.), chřestýši (Crotalus sp.), kobry (Naja sp.), převážně africké druhy.
Klinicky vznikají lokálně s možným šířením: bolest, otok, lymfadenopatie, v místě působení jedu puchýře, buly, hemoragie tkání, nekrózy a kompartmentový syndrom.
Léčebnou zásadou je minimalizace další traumatizace, drenážní poloha končetiny a symptomatická léčba včetně debridment a časné nekrektomie. Podání antibiotik je indikováno pouze při vzniklém infektu podle typu agens, před zjištěním původce se doporučují aminopeniciliny s betalaktamy, při alergii na ně linkosamidy.(6, 9) Zvláštním typem lokálního postižení je zásah očí tzv. plivající kobrou rodu Naja sp. Vzniká prudká bolest, konjunktivitida, keratitida až uveitida s možností trvalého poškození oka. Nutný je okamžitý výplach očí dostatkem tekutiny (voda, mléko…) a kontrola s léčbou očním specialistou.(6)
Komplement aktivující a alergizující složky
Složky jsou většinou proteinové povahy, způsobují lokální až systémové projevy alergie až anafylaktického nebo anafylaktoidního šoku. Složky jsou součástí všech jedů, komplement aktivující složky byly izolovány např. z jedu kober Naja sp.: CVF (cobra venom faktor) aktivující C3 a C5 složky komplementu. Příznaky jsou kožní projevy, otok až s generalizací, hypotenze, hemoglobinurie, šok. Při těžké anafylaxi je vysoká, časná až náhlá smrtnost.
Doporučuje se okamžité podání kortikosteroidů (metylprednizolon 1 mg/kg), při léčbě šoku adrenalin 0,3–0,5 mg (0,01 mg/kg) opakovaně po 20 minutách, dále antihistaminik typu antagonistů histaminových H1-receptorů (H1RA) – chlorfenyramin, antagonistů histaminových H2-receptorů (H2RA) – ranitidin, volumoterapie, oxygenoterapie a zajištění nebo náhrada základních životních funkcí. Nebezpečná je možnost zkřížené reaktivity jedů blanokřídlého hmyzu Hymenoptera s jedem naší zmije obecné Vipera berus. Alergie na jeden typ jedu s sebou nese alergii na typ druhý.(2, 3)
Klinický obraz uštknutí
Symptomatologie intoxikace je závislá na druhu hada, zastoupení složek jedu a jeho množství. Nejzávažnějšími projevy jsou krom těžké anafylaxe svalová paralýza, hypotenze, oběhový kolaps a šok, renální selhání, v časovém odstupu selhání hemokoagulace s krvácením, případně trombotickými komplikacemi. Velká část intoxikací začíná prodromálním stadiem: nauzea, vomitus, pocení, bolest břicha, hlavy, malátnost, spavost apod. Svalová paralýza počíná malátností, pokračuje obrnou postupující kraniokaudálně při většinou zachovaném vědomí. Fatální je bez léčby paralýza dýchacích svalů. Plný rozvoj intoxikace vzniká většinou za 20–60 minut.
Ovlivnění oběhu se projevuje nejčastěji hypotenzí, může přejít ve zhroucení oběhu a šok. Příčinou je vazodilatace, roli může hrát i extravazace tekutiny mimo cévní řečiště a porucha kontraktility myokardu. Vzácněji vznikají poruchy rytmu nebo hypertenze.
Renální selhání bývá oligoanurického typu a může nastat velmi časně po vzniku intoxikace.
Poruchy hemokoagulace se projeví nejprve v hemokoagulačním vyšetření, často mají konzumpční charakter. Klinické příznaky vznikají většinou až za několik hodin až desítek hodin. Projeví se krvácením, mnohdy orgánovým, včetně hemoragií do mozku.(2, 10)
Terapie obecně
Postiženého je vhodné zklidnit, při anxiózních nebo hysteroidních projevech podat sedativa. Při bolestech, které mohou být lokálně značné, se aplikují analgetika. Je třeba opatrnosti při podávání opiátů u pacientů exponovaných neurotoxinu pro potenciaci vlivů tlumících dech. Pro inhibici destičkových funkcí se nepodávají salicyláty. Vhodná je aplikace kortikosteroidů v dávce ekvivalentní 2–4 mg/kg hydrokortizonu.
Pacient se znehybní vsedě nebo vleže, zasaženou končetinu je nutno imobilizovat pomocí dlahy a pružného obinadla. Turniket způsobující žilní stázu nebo dokonce omezení arteriálního přívodu se nepřikládá. Ve speciálních případech (austropapuánští a mořští hadi, některé asijské kobry, mamby, korálovci, bungaři) se doporučuje přiložení imobilizační tlakové bandáže (těsná plošná bandáž celé končetiny s imobilizací na dlaze, podobně jako při úrazu) do doby finálního zajištění. Místo uštknutí se nerozřezává, nevysává, nevypaluje ani jinak specificky neošetřuje. Důležité je zjistit čas uštknutí a druh hada.
Transport postiženého je prováděn vleže do zdravotnického zařízení schopného zajistit nebo vyřešit závažné projevy jako ventilační insuficienci, oběhové selhávání a těžkou, atypickou poruchu hemostázy. Je-li podezření na intoxikaci sporné, není lokální ani celková reakce, od uštknutí uběhla doba řádově v desítkách hodin, je postačující umístění pacienta na standardní oddělení k vyšetření a observaci. Anafylaktický šok se léčí obvyklým způsobem (adrenalin, infuzoterapie, oxygenoterapie až řízená ventilace, kortikosteroidy v dávce ekvivalentní 30 mg/kg hydrokortizonu a další antihistaminická terapie).
Při vazodilataci a extravazaci s následným poklesem krevního tlaku až zhroucením oběhu se postupuje symptomaticky, plazmaexpanzí a katecholaminy. Po zjevném zásahu paralyzujícím neurotoxinem, při těžké svalové slabosti, ještě před plným rozvinutím příznaků, jsou na místě intubace a umělá plicní ventilace. Postižený pacient musí být adekvátně tlumen.
Selhání hemostázy, většinou s projevy krvácení a mikrotrombóz až trombóz, je léčeno symptomaticky a substitučně, v mnoha případech nastává zvrat až po podání antiséra.
Při zásahu oka tzv. plivajícími kobrami, např. kobrou černokrkou Naja nigricollis, se provádí výplach borovou vodou, fyziologickým roztokem, vodou nebo mlékem. Pro velkou bolestivost je vhodná aplikace lokálního anestetika do spojivkového vaku. Následně je třeba řešit poškození oka s očním specialistou.
Imunoterapie antisérem je indikována pouze při výskytu celkových příznaků intoxikace. Antiséra, většinou koňská, způsobují často závažné anafylaktické reakce, navíc, antigenita některých složek jedu je sporná nebo nízká. Jejich rutinní podávání může být kontraproduktivní. Aplikují se v pomalé infúzi naředěná do 500 ml po antihistaminické přípravě. Odstranění složek hadích jedů je možné také plazmaferézou.
Léčba lokálního postižení vyplývá z typu poškození. V zásadě je nutné chovat se k poškozené tkáni šetrně, vhodná je lehká elevace, imobilizace a mírné chlazení. Prevencí vzniku hlubokých nekróz je při nebezpečí vzniku kompartmentového syndromu měření tkáňového tlaku s časnou reakcí na jeho zvýšení, viz výše, při těžké poruše perfúze fasciotomie. Vzniklé nekrózy vyžadují včasnou nekrektomii.
Součástí léčby je vždy kontrola nebo zajištění prevence tetanu.(2, 5, 6, 9, 10)
Uštknutí zmijí obecnou (Vipera berus)
Charakteristika
Zmije obecná je v ČR jediným volně žijícím jedovatým hadem. Jedový aparát je solenoglyfního typu s erektilními zuby. Hlavu má trojúhelníkovitou, zornice vertikálně štěrbinovité. Zbarvení je variabilní se základními tóny hnědé, šedé a černavé barvy. Charakteristický tmavý klikatý pruh není nezbytností, existují černě a červenavě zbarvené formy bez kresby.
Biotop a areál výskytu
Zmije obecná obývá rozmanitý biotop: lesy, paseky, stráně, kamenité terény, okolí vodních ploch, bažin a slatiny. Není vyloučen její nález ve vodě. V ČR se zmije obecná vyskytuje do výše 1500 m n. m., nejhojněji v horách a podhorských oblastech. Aktivní je většinou ve dne a za soumraku, v místech s vyšší teplotou a v horkém letním období i během noci.
Epidemiologie uštknutí
V ČR bylo v rozmezí let 1999–2006 v Toxinologickém centru Všeobecné fakultní nemocnice v Praze konzultováno zhruba kolem stovky případů. Ve více než polovině z nich však nedošlo k aplikaci jedu, nebyly zaznamenány ani lokální reakce nebo byly nepatrné. Registrované případy kousnutí zmijí obecnou v jednotlivých evropských státech jsou shodně v řádu desítek až stovek ročně.
K úmrtí dochází extrémně vzácně, za posledních 20 let nebylo v ČR zaznamenáno.(1, 3)
Toxiny
Jed zmije obecné je enzymového typu. Množství sušiny jedu dospělé V. berus většinou nepřesahuje 15 mg, což je asi 60 % odhadované letální dávky pro člověka. Při obranném kousnutí vypouští zmije jen jeho menší část nebo jej nevypustí vůbec.
Jed obsahuje převážně složky s vazodilatačním účinkem a hemoraginy zvyšujícími permeabilitu kapilár. Látky cytotoxické a látky ovlivňující hemokoagulaci obsahuje v míře uplatňující se pouze lokálně, neobsahuje paralyzující postsynaptické neurotoxiny, kardiotoxiny, myotoxiny a látky nekrotizující. Slabé presynaptické neurotoxiny ovlivňující vegetativní aparát a inervaci svalů obličeje se vzácně vyskytují u některých poddruhů.(1, 3, 11)
Lokální příznaky intoxikace
Po plném zákusu se v místě objeví dvě drobné, většinou bolestivé ranky se zarudlým či lividním okrajem. Nedokonalý vkus může způsobit jednu ranku nebo pouze škrábnutí. Známkou intoxikace bývá bolestivý otok doprovázený zduřením regionálních lymfatických uzlin. Maxima dosahuje obvykle do 48 hodin, vzácně se rozšiřuje na trup, nebo dokonce na protilehlou polovinu těla. Může mít až hemoragický charakter. Infekční komplikace, flegmóna či absces, jsou vzácné. Ústup nekomplikovaných lokálních projevů lze očekávat za 3–4 dny, v těžších případech za týden i déle.(3, 10, 11)
Celkové příznaky intoxikace
Prvními příznaky intoxikace jsou nauzea, vomitus, pocení, zvýšená teplota a žízeň. Stav bývá doprovázen abdominálními bolestmi, průjmem, někdy inkontinencí. Tyto symptomy ukazují na střední až závažnější míru intoxikace, mohou přetrvávat až 48 hodin. Vzácněji se objeví angioneurotický edém s maximem v oblasti rtů, jazyka a tváře. Dechové obtíže, pokud se objeví, jsou pravděpodobně rovněž způsobovány anafylaktoidními bronchospazmy. Nebezpečným projevem intoxikace je pokles systémového tlaku, cirkulační kolaps až šok.(10, 11, 12)
Spontánní krvácení po uštknutí V. berus je raritní. Zaznamenány jsou vzácné lehké projevy neurotoxicity, oftalmoplegie, ptóza víček, dysfonie a dysfagie; neobvyklý nález byl popsán při intoxikaci jedem zmije skvrnité V. aspis.(13) Nejnebezpečnějším postižením po uštknutí je těžká anafylaxe se šokem. Jed zmije obecné má zkříženou imunitní reaktivitu s jedem blanokřídlého hmyzu; po vzniku alergie na tento jed lze očekávat alergii na druhý a vice versa.
Při běžných intoxikacích s celkovými projevy dochází k normalizaci systémových změn do několika dnů, vzácně později. Nejčastějším laboratorním nálezem je leukocytóza. Je-li závažná (20x 109/l), ukazuje na těžší stupeň intoxikace. Nehrazený únik tekutiny, iontů a proteinů zvyšuje hladiny hematokritu (Hct) a hemoglobinu (Hb), velmi vzácně může dojít k anemizaci při hemolýze a extravazaci erytrocytů. Přítomna bývá proteinurie, vzácně hemoglobinurie.(3, 10, 11, 12)
Terapie
Uštknutí zmijí obecnou neznamená většinou pro dospělého člověka závažné ohrožení, přesto je nutno k intoxikaci přistupovat s plnou vážností a zajištěním postiženého. U dítěte je tento přístup naprostou samozřejmostí; vzhledem k jeho váze může být množství jedu již v uvažované dávce letální. První pomoc spočívá v imobilizaci postižené končetiny volnější bandáží na dlaze a znehybněním pacienta samotného, v žádném případě se nedoporučuje zbytečný pohyb. Tradované manipulace s ranou, stejně jako přiložení turniketu je škodlivé a neprovádí se. Pokud nedochází k rozvoji celkových příznaků intoxikace, je možno podávat nápoje, káva s kofeinem nebo alkohol nejsou vhodné. Je-li v dosahu zdravotnická pomoc, je třeba ji neprodleně povolat.
Nejvhodnější je sanita rychlé zdravotnické pomoci, zvláště v případě časného nástupu lokálních změn nebo celkových příznaků a zcela samozřejmě ve všech případech kousnutí dítěte. Ani v případě bezpříznakového nebo mírného průběhu počátku intoxikace nelze vyloučit v čase minut až desítek minut závažné projevy intoxikace. Je doporučeno časné podání kortikosteroidů v dávce 2–4 mg/kg tělesné hmotnosti hydrokortizonu, nebo tomu odpovídající dávky metylprednizolonu, i. v. nebo i. m., které oslabí případné anafylaktické komplikace a pravděpodobně zmírní celkovou reakci při intoxikaci.
Rozvoj alergické reakce nebo anafylaktického šoku se řeší podle obecných zásad. Podání antiséra není v přednemocniční fázi terapie indikováno. Transport pacienta je prováděn do nejbližšího nemocničního zařízení, které je schopno zvládnout akutní stav pacienta, především cirkulační selhání. Při mírných příznacích u dospělých postačí vyšetření a několikahodinová observace. U dětí je nutná observace i po kousnutí bez příznaků intoxikace, při intoxikaci pak hospitalizace na pracovišti schopném zvládnout i těžší průběh intoxikace s komplikacemi, nebo alespoň v jeho dosahu.
Běžné projevy celkové intoxikace: nauzea, vomitus, bolesti břicha, průjem, slabost, pocení se řeší symptomaticky. Při poklesu tlaku je nutno zvýšit a stabilizovat tenzi objemovou nabídkou, v případě cirkulačního kolapsu nebo šoku doplnit objemovou náhradu vazopresorickou léčbou. Zvýšení intravazální náplně infuzoterapií je prevencí selhání ledvin, které vždy při intoxikaci jedem zmije obecné hrozí.(3, 11) Léčba antisérem, tedy jeho podání, podléhá indikaci. Tou je během nemocniční léčby uštknutí V. berus a ostatních evropských zmijí přítomnost některé ze známek závažnější systémové intoxikace:
a) Hypotenze špatně reagující nebo nereagující na volumoterapii, nutnost užití katecholaminů, rekurence hypotenze, cirkulační kolaps nebo šok.
b) Přítomnost a rekurence závažnějších celkových příznaků intoxikace, zvláště z gastrointestinálního traktu nebo centrálního nervového systému.
c) Leukocytóza (vyšší než 20x 109/l), acidóza, EKG změny, zvýšená hodnota sérové CK nebo jiná závažnější laboratorní patologie, laboratorní nebo klinický nález hemokoagulační dysregulace, hematurie, proteinurie apod.
d) Výskyt extenzívního otoku, zvláště hemoragického.
e) U dětí výskyt jakýchkoliv závažnějších nebo přetrvávajících příznaků celkové intoxikace.(3, 11, 12) V současné době je doporučené k použití ovčí Fab antisérum ViperaTAb®, Protherics, USA. Sérum je dostupné v Toxikologickém informačním středisku Kliniky nemocí z povolání 1. LF UK Praha, jeho vydání podléhá schválení Toxinologického centra Kliniky anesteziologie, resuscitace a intenzivní medicíny Všeobecné fakultní nemocnice (KARIM VFN) 1. LF UK Praha.
Stále běžně dostupné sérum Antitoxinum Vipericum, Biomed, Polsko, již nelze pro možné alergizace obecně doporučit. Sérum se podává přednostně intravenózní infúzí naředěné do 500 ml. Aplikace do svalu se považuje za neúčinnou, infiltrace okolní tkáně nemá opodstatnění. Při přetrvávání nebo návratu symptomatologie je nutno podání séra opakovat. Test na alergii intradermálním podáním zředěného antiséra se nedoporučuje. Před podáním antiséra je vhodná antihistaminická příprava.(3, 15) Lokální poškození tkáně nebývá významné, postačí šetrnost, elevace končetiny a mírné chlazení. Kortikosteroidy ani terapie sérem pravděpodobně neovlivní průběh lokálních změn.
Antibiotika se podávají pouze při vzniku bakteriálně podmíněného zánětu, nikdy preventivně. Je indikována antitetanická prevence. Do domácího ošetření může být pacient propuštěn po úplném odeznění celkových příznaků a stabilizaci těžších lokálních změn. Laboratorní obraz přetrvávající protrombotické aktivity je vhodné zajistit do normalizace miniheparinizací nebo antiagregací.(3)
Poranění dalšími jedovatými živočichy
Pavouci (Araneida)
Přes medializaci a rozšířenou arachnofobii nepředstavují pavouci až na možné výjimky v ČR pro člověka vážné nebezpečí. Celosvětově existuje jen několik druhů, jejichž kousnutí může mít pro člověka závažné až fatální následky.
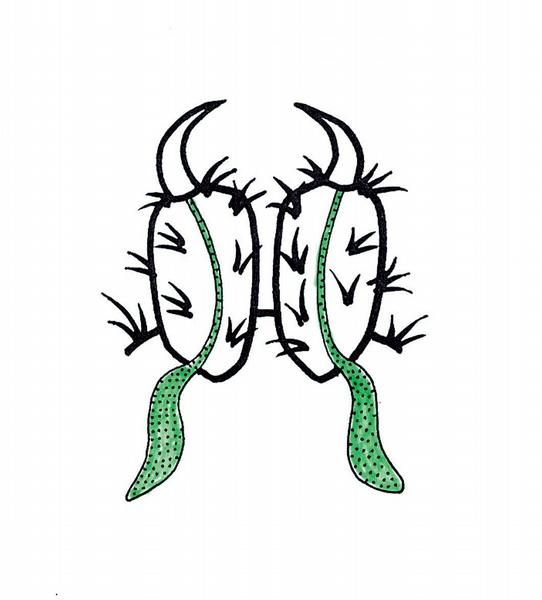
Jedový aparát tvoří dvoučlenné chelicery, jejich články jsou ohnuty dolů a dozadu (Obr. 4), nebo jsou obráceny proti sobě na způsob kleští (Obr. 5). Nejzávažnějšími složkami jinak druhově specifických jedů jsou neurotoxiny postihující autonomní i motorické nervstvo. U smrtelně nebezpečného druhu australských sklípkanů Atrax robustus je hlavní komponentou účinný presynaptický neurotoxin.

Nejvýznamnější složkou jedu drobných a nenápadných snovaček Latrodectus sp., vyskytujících se i v jižní Evropě a známých také pod názvem „černá vdova“, je neurotoxin s výrazným parasympatomimetickým účinkem. Neurotoxiny jsou zastoupeny i v jedech běžně chovaných sklípkanů Theraphosidae, kousnutí většiny druhů však není nebezpečné. Neurotoxické příznaky mohou způsobit zástupci rodů Sericopelma, Phormictopus, Acanthoscurria i často chovaný jihoamerický druh Theraphosa blondii. Závažné lokální nekrózy způsobuje jed amerických a afrických pavouků rodu Loxosceles.
Příznaky kousnutí pavouků jsou lokální bolest, otok, erytém a mnohdy přetrvávající parestézie. U většiny běžně chovaných druhů sklípkanů Theraphosidae, evropských křižáků Araneidae a jiných našich pavouků se následky kousnutí, vyloučíme-li anafylaxi, omezují na lokální změny.
Typickým příznakem po kousnutí snovačkou Latrodectus sp. je zpočátku malá nebo žádná bolest, jejíž intenzita se zvyšuje a je provázena lymfadenitidou. Latrodektismus jako syndrom systémové intoxikace zahrnuje škálu příznaků: kloubní a abdominální bolest, diarea, třes, slabost, psychická alterace, fotofobie, salivace, slzení, pocení, febrilie nebo hypotermie, dyspnoe, plicní až generalizovaný edém, změny na EKG odpovídající ischémii myokardu, oběhová nestabilita často s výraznou hypertenzí až oběhové selhání.
K paralýze dýchacích svalů však nedochází a úmrtí je velmi vzácné. Většinou se však u jihoevropských snovaček intoxikace projeví pouze nevolností, zvýšenou teplotou a lehkou vegetativní dysbalancí (tzv. nemoc sekáčů trávy). Syndrom podobný latrodektismu byl popsán také po kousnutí běžným evropským křižákem.
Ve všech případech kousnutí pavoukem dodržujeme zásady první pomoci a nespecifické terapie uvedené ve stati o uštknutí jedovatými hady. Důležité je zajištění živého či mrtvého pavouka pro identifikaci. Proti jedům nejnebezpečnějších pavouků Latrodectus sp., Atrax robustus., Loxosceles sp. se vyrábejí antiséra. V ČR nejsou dostupná, v mimořádných případech je lze získat z jiného evropského toxinologického centra.(10, 16, 17)
Štíři (Scorpiones)
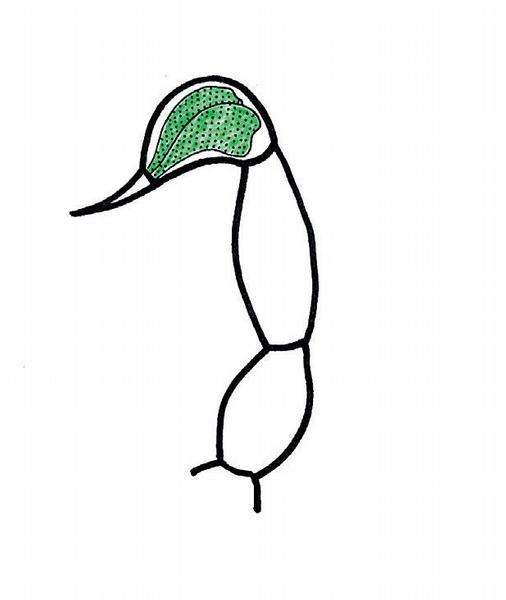
Štíři jsou v našich podmínkách chováni v teráriích, bodnutí některými druhy však může být závažné až smrtelně nebezpečné. Naštěstí nejatraktivnější, nejčastěji chovaný druh, africký veleštír obrovský Pandinus imperator je velmi málo jedovatý a jeho bodnutí působí ve většině případů jen lokální bolest. Z afrických a asijských štírů jsou nejnebezpečnější rody Leiurus, Buthus, Parabuthus, Hottentotta a Androctonus. Smrtelně nebezpečné jsou americké rody Centruroides a Tityus. Jedovým aparátem je telson, poslední článek zadní části zadečku, který je zakončen dutým hrotem, do něhož ústí dvě jedové žlázy (Obr. 6).
Hlavními složkami jedu štírů účinnými na člověka jsou neurotoxiny blokující sodíkové, draslíkové a kalciové kanály s následnou poruchou nervového a neuromuskulárního vedení nebo kontrakce svalových buněk samých.
Typickým příznakem je okamžitá silná palčivá bolest, která přetrvává několik dnů, vzniklé parestézie i několik týdnů. Jed většinou nepůsobí nekrózy, místo bodnutí může být jen mírně oteklé se začervenáním. Systémová intoxikace se projevuje v závažných případech zvýšenou salivací, slzením, dysfagií, dysfonií, pocením, nauzeou, vomitem, abdominální bolestí, diareou, dyspnoí, plicním edémem, bradykardií nebo tachykardií, arytmiemi a poruchami vedení patrnými na EKG, hyper- nebo hypotenzí, oběhovým selháním až šokem. Rekonvalescence může trvat různě dlouhou dobu, zvláště bez použití antiséra. Nejčastější příčinou vzácného úmrtí je paralýza dýchacích svalů a oběhové selhání.
První pomoc a nespecifická terapie je stejná jako při uštknutí jedovatými hady. Proti nejnebezpečnějším druhům se vyrábí antiséra, která však nejsou v ČR k dispozici, v mimořádných případech je lze získat z jiného evropského toxinologického centra.(10, 17, 18) Stonožky (Chilopoda) Stonožky mají jako jedový aparát kusadlové nožky s jedovou žlázou. Žádná evropská stonožka není člověku nebezpečná, avšak často jsou chovány různé druhy velkých tropických stonožek rodu Scolopendra. O složení jejich toxinů není mnoho informací, některé mimoevropské druhy mohou ojediněle způsobit i závažné systémové intoxikace, které se léčí symptomaticky. Antiserum se nevyrábí.(10, 17)
Aktivně jedovaté ryby
Jedovaté ryby jsou v našich podmínkách chovány v akváriích, nebo je možno se s nimi nejblíže setkat při běžných pobytech u Středozemního moře nebo Atlantiku. Chováni bývají zástupci sumců Siluroidei a jiných ryb, u kterých je vyvinut jedový aparát v podobě ostnů a jedové žlázy na prsních nebo hřbetních ploutvích. V mořských akváriích je možné se setkat s perutýny Dendrochirus sp. a Pterois sp., kteří jsou vybaveni množstvím dlouhých ploutevních trnů s jedovými žlázami. Poranění je silně bolestivé, otok může zasáhnout až do mízních uzlin a není vyloučena tvorba nekróz.
V jihoevropských mořích je možný kontakt s rybami čeledi ropušnicovitých Scorpaenidae a jejich zástupci odrancem Synaecia, perutýnem Pterois, ropušnicemi Inimicus, Scorpaenopsis, Scorpaena a některými rejnoky. Dále zde žijí ostnatci Echiichthys (dříve Trachinus), např. známý Echiichthys (Trachinus) draco s jedovými trny nad očima a na skřelích. Poranění bývá až extrémně bolestivé a může vést k dlouhotrvajícím parestéziím. I když se většinou při poranění jedovatými rybami a parybami vyvine pouze lokální postižení, nelze úplně vyloučit vznik systémové intoxikace včetně anafylaxe. Může se objevit malátnost, gastrointestinální obtíže, poruchy vědomí, oběhu a dechu.
Terapie projevů je symptomatická. V některých případech extrémní lokální bolesti (např. ostnatec Trachinus) pomáhá okamžitá expozice zasažené končetiny s termolabilními toxiny vyšší teplotě (horká voda, vysoušeč vlasů), někdy je nutná i účinná analgezie, výjimečně až aplikace lokální anestézie.(10, 17, 19)
Blanokřídlý hmyz (Hymenoptera)
Nejvýznamnější zástupci ve střední Evropě, sršeň obecná Vespa crabro, vosa obecná Paravespula vulgaris, vosa útočná Paravespula germanica a včela medonosná Apis melifera, patří mezi aktivně jedovaté druhy hmyzu. Jedový aparát je tvořen jedovými žlázami, jedovým vakem a žihadlem. Umístěn je v zadní části zadečku.
Jedy obsahují biogenní aminy jako histamin, dopamin, adrenalin, noradrenalin, serotonin a acetylcholin, hydrolytické enzymy a peptidy (např. melittin) porušující buněčné struktury detergentním a kininovým účinkem.
Prvním příznakem je palčivá bolest a lokální otok v místě bodnutí. Normální průběh intoxikace je omezen pouze na lokální příznaky. Závažné komplikace jsou způsobeny jednou ze tří příčin: – mnohonásobné pobodání vede k systémové intoxikaci účinkem velkého množství aplikovaného jedu, za život nebezpečná se považují řádově desítky bodnutí, – bodnutí do úst, dýchacích cest nebo krku s následným edémem omezujícím průchodnost dýchacích cest, – těžká anafylaktická reakce.
Existuje zkřížená imunitní reakce s jedem zmije obecné – viz výše.
Intoxikace jedem blanokřídlých vyvolává vzhledem ke složení jedu systémovou reakci podobnou anafylaxi až šoku. K situaci dochází i po jediném bodnutí u přecitlivělého jedince. Opakovaná expozice toxinu přitom není podmínkou.
Otok v místě bodnutí větší než 10 cm, generalizované svědění, urtika a nevolnost je třeba považovat za abnormální reakci. Může progredovat přes úzkost, nauzeu, zvracení, abdominální bolest, průjem, hrudní oprese, závrať, zmatenost, angioneurotický edém až k šoku s oběhovým a respiračním selháním. Terapie reakce na bodnutí blanokřídlými je u všech druhů shodná. U včel zůstává v místě celý jedový aparát; je třeba jej vyjmout, aniž by došlo ke kompresi jedového váčku. Lokální chlazení zmírňuje bolest a může omezit rozvoj otoku. Při bodnutí do krku, úst, nebo dýchacích cest musí být postižený observován s možností zajištění průchodnosti dýchacích cest. Podává se adrenalin v aerosolu nebo i. v., beta2-mimetika (např. salbutamol) v aerosolu a kortikosteroidy, přednostně i. v. Systémové projevy intoxikace lze zmírnit antihistaminickou terapií. V závažnějších případech se postupuje shodně s léčbou těžké anafylaktické reakce.(10, 17, 20)
O autorovi: MUDr. Jiří Valenta, Univerzita Karlova v Praze, 1. lékařská fakulta a Všeobecná fakultní nemocnice, Klinika anesteziologie, resuscitace a intenzívní medicíny











