Předložený přehled odpovídá nejen na řadu praktických otázek, ale snaží se zpřístupnit i metabolický pohled na celou problematiku.
Summary
Bultas, J. Treatment of hypertension – not only a decrease in blood pressure, but also the metabolic aspect is important
Arterial hypertension is, along with dyslipidemia, the most severe risk factor of atherothrombotic events – especially strokes. Rigorous treatment of hypertension leads to a fundamental affection of both morbidity and mortality. Main target of the treatment approach is to achieve a sufficient decrease in blood pressure, nevertheless metabolic aspects of treatment are of practical importance too. This review not only answers a number of practical questions, but is also trying to access the metabolic view of the whole issue.
V posledním desetiletí jsme svědky určitého schizmatu ve vývoji kardiologie – zatímco v intervenční léčbě akutních forem ICHS patříme mezi světovou špičku, v prevenci a léčbě rizikových faktorů aterogeneze máme stále velké rezervy. Ty mají jak léčba dyslipidémie, hypertenze či diabetu, tak intervence kuřáckého návyku. Typickým případem je hypertenze – v dospělé populaci trpí hypertenzí asi třetina osob, jen asi 2/3 osob se zvýšeným krevním tlakem o své chorobě ví a jen asi polovina všech (odhalených i neodhalených) hypertoniků je léčena. Bohužel cílových hodnot tlaku však dosahujeme jen u menší části. Pravdou je, že u nás pouze pětina hypertoniků má krevní tlak dobře kontrolovaný. Bohužel ani v ostatních státech Evropy či v USA není stav o mnoho lepší.
Důvodem jsou jak rezervy na straně zdravotní péče, tak i nedostatečná informovanost a přezírání závažnosti situace z pohledu nemocného. Mnoho lékařů význam důsledné kontroly hypertenze podceňuje a v intervenci zůstávají v půli cesty. Často neadoptují údaje o optimálních hodnotách krevního tlaku, podceňují zejména výšku systolického tlaku, nedoceňují význam léčby starších nemocných, nerespektují základní pravidla farmakoterapie a již vůbec neléčí hypertonika „komplexně“, tj. ve vztahu k ostatním rizikovým faktorům. Tento přehled by měl shrnout současné názory na racionální léčbu hypertenze a zejména poukázat na specifika léčby hypertonika ve specifických situacích.
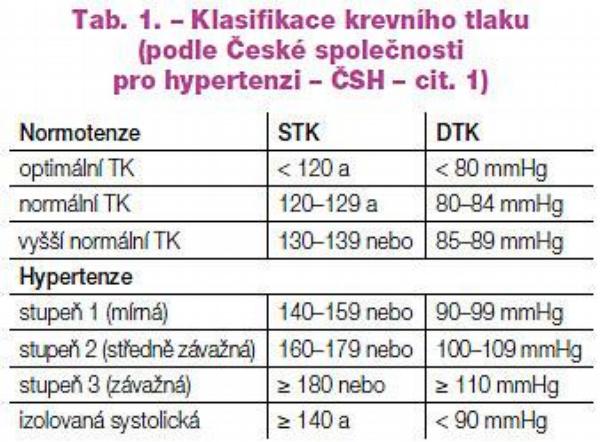
Definice a klasifikace hypertenze
Jaký je optimální krevní tlak? Vzhledem k tomu, že hodnoty krevního tlaku jsou v populaci spojitou veličinou, musela být normální hodnota tlaku stanovena arbitrárně. Hranice se v průběhu let snižovala podle toho, jak byly k dispozici výsledky kontrolovaných klinických studií, jak byla zaváděna výhodnější antihypertenzíva a jak se vyvíjel tlak civilizačních faktorů. V současné době je za hypertenzi považován tlak od 140/90 mmHg. Existují však názory, že optimální hodnota krevního tlaku (vzhledem k riziku vývoje kardiovaskulárních onemocnění) je ještě nižší, tj. pod 120/80 mmHg. Cílová hodnota krevního tlaku by pro léčeného hypertonika s dalšími rizikovými faktory měla být pod 130/80 mmHg. U diabetiků, u nemocných s metabolickým syndromem, u nemocných s renální dysfunkcí a s proteinurií, u nemocných po infarktu myokardu či s vysokým rizikovým skóre by se měl krevní tlak dokonce pohybovat ještě níže, tedy kolem 120/80 mmHg.(1) Specifickou podjednotkou je izolovaná systolická hypertenze (s STK od 140 mmHg při DTK pod 90 mmHg), která se objevuje zejména s přibývajícím věkem (Tab. 1). I tento typ hypertenze je nutno velmi důsledně léčit, kritéria pro cílovou hodnotu krevního tlaku jsou stejná. Rozhodně již neplatí, že by u starších lidí neměla být systolická hypertenze léčena.
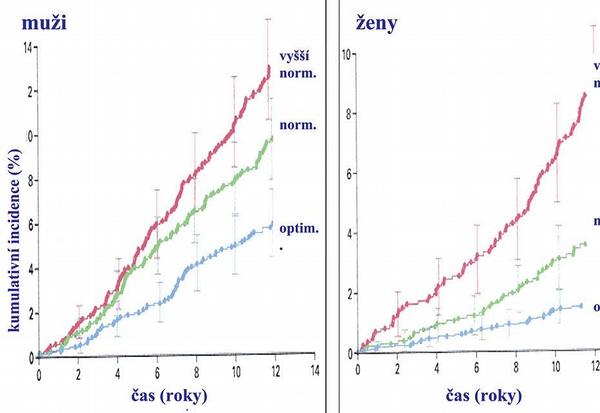
Rozdělení hodnot krevního tlaku v rámci normotenze na optimální, normální a vyšší normální tlak má své opodstatnění. Při sledování prognózy mají totiž i „normotenzní“ osoby významně lepší prognózu, pokud byl výchozí krevní tlak v rámci optimálních hodnot; naopak probandi s vyšším normálním tlakem měli prognózu horší než ženy i muži v pásmu normálního tlaku (Obr. 1).
Přístup k léčbě hypertenze – strategie v různých situacích
Vedle výšky krevního tlaku, což je jistě nejvýznamnější veličina, kterou důsledně intervenujeme, má význam i komplex metabolických odchylek, který mechanismy kontroly krevního tlaku navodí. Primitivní defenzívní a regulační pochody totiž sdružovaly více obranných strategií. Na jedné straně bylo jistě důležité udržet krevní tlak, tedy akcelerovala presorická funkce; na straně druhé však bylo neméně důležité aktivovat hemostatické pochody a pochody reparační. Tyto základní linie obrany pak přetrvávají například v ose renin-angiotenzin-aldosteron (RAA) od primitivních obojživelníků, kdy bylo nutno zajistit homeostázu při přechodu z oceánu na souš, či v sympatoadrenální aktivaci zapojující se v „boji a v útěku“.
Uvědomíme-li si tyto základní principy fylogeneze, nepřekvapí nás, že aktivace presorických mechanismů, zejména systémů RAA, sympatoadrenálního, endotelinového, prostanoidového či apelinového, nezvýší jen krevní tlak, ale aktivuje metabolické pochody vedoucí ke zlepšení nabídky energetických zdrojů. Setkáváme se s vyplavením glukózy a mastných kyselin, tedy jedním z projevů metabolického syndromu. Podobně dochází k nastartování hemostázy a reparačních pochodů – tedy objevuje se hyperkoagulační stav a aktivují se molekuly akutní fáze a zánětlivé cytokiny. Tento komplex změn, trvá-li dlouho, ve svém důsledku navodí změny provázející aterogenezi a trombogenezi.
V praxi se pak setkáváme s chorobami na aterotrombotickém podkladě, zejména s cévními mozkovými a koronárními chorobami. Zdá se, že jednotlivé složky se uplatní v různých systémech s jinou závažností, tj. v léčebné strategii pak pozorujeme menší dopad inhibice sympatoadrenální hyperaktivace betablokátory na mozkovou cirkulaci, tedy nižší efekt betablokátorů na prevenci iktů, ale jejich plný účinek na věnčité cévy, tedy na profylaxi příhod koronárních. Budeme si tak muset uvědomovat, v jaké situaci hypertonika léčíme, a jinou strategii volit u diabetika či nemocného se srdečním selháním a jinou u mladého jedince s hypercirkulací. Shrneme-li, je na prvním místě snaha o dosažení optimálních hodnot krevního tlaku v denních i nočních hodinách, nicméně při volbě léčebného postupu je nutno respektovat metabolické ladění organismu a přidružené komorbidity.
V praxi to znamená, že např. diuretika se prosadí v léčbě pro svůj mohutný antihypertenzní efekt navzdory svým spíše negativním metabolickým vlastnostem; nicméně volíme-li u hypertonika stran poklesu tlaku stejně účinnou kombinaci inhibitorů ACE s blokátory kalciového kanálu (BKK), tedy metabolicky příznivou kombinaci, docílíme výraznějšího poklesu kardiovaskulárních příhod a mortality. V léčbě je vlastní snížení krevního tlaku jen prostředkem, ale cílem je vždy zlepšení prognózy nemocného. Z tohoto hlediska nutno zdůraznit, že nemocného, který k nám přichází pro hypertenzi, stejně intenzívně léčíme pro dyslipidémii či se stejným nasazením intervenujeme kuřácký návyk.
Proč hypertenzi léčíme?
Až do poloviny 20. století převládal názor, že hypertenze je jen fyziologický regulační mechanismus a největší nebezpečí pro hypertonika tkví v tom, že nějaký horlivý lékař začne hypertenzi léčit. Jedním z prvých propagátorů léčby hypertenze byl prof. Antonín Vančura. V jeho době byla léčba postavena na diureticích a alkaloidech Rauwolfie. Teprve později se objevily léky inhibující sympatoadrenální systém (ß- a ?-blokátory, event. centrálně působící antihypertenzíva), inhibitory osy renin-angiotenzinaldosteron (blokátory aldosteronových receptorů, inhibitory ACE a sartany) či periferně působící antihypertenzíva (zejména blokátory kalciového kanálu). Je paradoxní, že doklady o snížení morbidity léčbou hypertenze byly podány až v sedmdesátých letech a snížení mortality dokonce až v devadesátých letech.
Nejpřesvědčivější je dopad kontroly hypertenze na pokles cerebrovaskulárních příhod. Výsledky klinických studií, do kterých bylo zapojeno dnes již více než sto tisíc hypertoniků, ukazují, že snížení systolického tlaku o 10–15 mmHg a diastolického tlaku o 5 mmHg sníží riziko mozkové příhody téměř o polovinu, riziko koronárních příhod o pětinu a riziko všech kardiovaskulárních příhod zhruba o třetinu.(2, 3) Tento vztah platí též pro recidivu mozkových příhod. Například ve studii PROGRESS (kde byla užita kombinace diuretika indapamidu a inhibitoru ACE perindoprilu) byl pokles systolického tlaku o 9 mmHg a diastolického o 4 mmHg následován 28% snížením recidivy iktu.
Obdobné doklady o efektu antihypertenzní léčby v primární či sekundární prevenci máme pro kardiovaskulární příhody. Analýza studií SHEP a Syst-EUR dokumentuje, že pokles systolického TK o 10–12 mmHg vedl ke snížení incidence ischemické choroby srdeční asi o třetinu. Též v prevenci ischemické choroby dolních končetin je léčba hypertenze úspěšná. Není však doložen příznivý účinek kontroly krevního tlaku na progresi do stadia kritické končetinové ischémie a nutnosti amputace.
Není pochyb, že hypertenze je zatížena výskytem chronických renálních onemocnění – od mikroalbuminurie až po terminální renální selhání. Jak výskyt, tak jejich progrese jsou výrazně potencovány koincidencí s diabetem. Také různé typy nefropatií přispívají ke vzniku hypertenze a k progresi orgánových komplikací. Tedy vazba oboustranná. Léčba hypertenze a výběr antihypertenzív
V léčbě hypertenze je nesmírně důležitá dobrá spolupráce s nemocným. Prvním krokem je proto vysvětlení podstaty a rizika vysokého krevního tlaku a zdůraznění, že cílem není jen pokles krevního tlaku, ale zejména zabránění cerebrovaskulárním a kardiovaskulárním chorobám. Dále je třeba navrhnout zásah do životosprávy a je-li indikace, pak započít s farmakoterapií.
Jak bylo řečeno, na vzestupu tlaku se uplatňuje řada faktorů. Jeden z regulačních mechanismů má však zcela mimořádné místo. Tím je „nejrobustnější“ systém kontroly tlaku, tedy osa renin-angiotenzin-aldosteron. Tento systém nejenže kontroluje periferní rezistenci a objem volumu, ale zasahuje i do reparačních dějů, tedy do proliferace, zánětu a hemostázy. Navíc ovlivňuje i řadu metabolických pochodů v rámci adaptace na stres. Proto by vždy měla být antihypertenzní léčba přednostně směřována na útlum této osy. Výhodou je příznivý dopad na degenerativní a trombotické pochody v cévní stěně (zpomalení aterotrombózy) nezávisle na poklesu TK i příznivé ovlivnění metabolismu lipidů a glycidů či již přímo metabolického syndromu. Podobně pozitivní efekt na lokální procesy v cévní stěně při neutrálním systémovém metabolickém účinku mají blokátory kalciového kanálu.
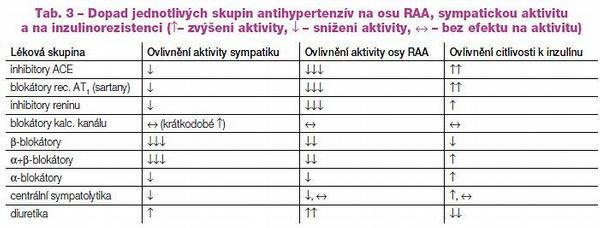
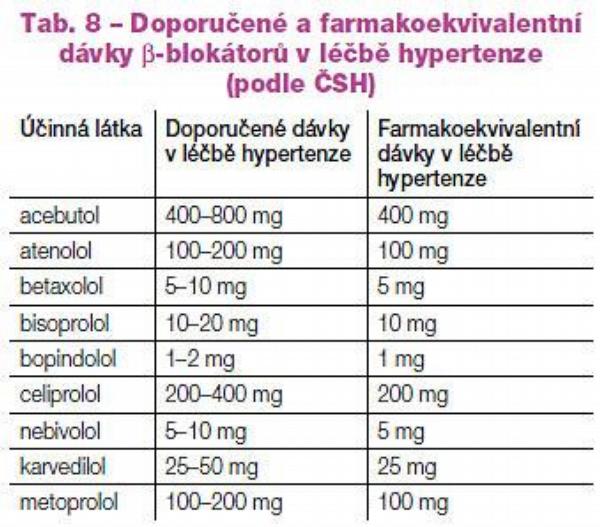
Naopak diuretika aktivují osu RAA a mohou tak nepříznivě ovlivnit zánětlivé a degenerativní pochody v rámci aterogeneze. Ve vyšších dávkách tímto mechanismem nepříznivě ovlivňují metabolismus lipidů a glycidů. Velkou předností diuretik je přetrvávající aditivní antihypertenzní efekt i v antihypertenzních „koktejlech“. Proto je jejich místo přednostně v kombinacích s léky blokujícími systém RAA či s BKK. Podobný negativní metabolický efekt mohou mít blokátory adrenergních receptorů ß, vyplývající ze snížení citlivosti tkání k inzulínu a zvýšení hladiny triglyceridů. Proto i tuto skupinu volíme optimálně až do kombinace s metabolicky pozitivně či neutrálně působícími léky a dvojkombinaci s diuretiky se raději vyhneme. Kombinované ?+ß-blokátory (např. karvedilol) tento nepříznivý dopad na metabolismus lipidů a glycidů nemají. Doporučené léčebné postupy uvádějí jako základní řadu antihypertenzív inhibitory ACE, blokátory receptorů AT1 (sartany), blokátory kalciového kanálu, diuretika (zejména thiazidová) a ß-blokátory.
Vedle těchto antihypertenzív prvé řady, tj. skupin majících vedle antihypertenzního účinku též dobře dokumentovaný i příznivý dopad na mortalitu a morbiditu, máme i antihypertenzíva řady druhé. Tyto skupiny léků bohužel nemají provedeny prognostické studie a jejich indikace vyplývá pouze z antihypertenzního účinku (Tab. 2). Antihypertenzíva druhé volby, tj. blokátory ?-adrenergních receptorů, periferně a centrálně působící sympatolytika (agonisté ?2-receptorů a agonisté imidazolinových receptorů) či přímé vazodilatátory jsou určeny ke kombinační léčbě hypertenze se základní řadou.(1) Se zpřísněním cílových hodnot kontroly hypertenze je stále více nemocných léčeno kombinací antihypertenzív. Je to trend jistě žádoucí. Kombinování různých skupin léků potencuje vlastní antihypertenzní efekt a umožní snížit dávku jednotlivých léků, což vede k lepší toleranci a ke snížení nákladů na léčbu.
Při léčbě je vhodné vybrat antihypertenzívum či kombinaci antihypertenzív s ohledem na inzulínovou rezistenci a ovlivnění aktivity osy renin-angiotenzin-aldosteron a sympatoadrenální stimulaci. Výhodné je adrenergní aktivitu i osu RAA tlumit, naopak citlivost k inzulínu stimulovat. Z pohledu příznivého dopadu na inzulinorezistenci jsou výhodné inhibitory ACE a sartany, event. i inhibitory reninu (aliskiren). Příznivý efekt pak má i ?+ß-blokátor (karvedilol), kombinace ß-blokátorů s ?-blokátory. Blokátory kalciového kanálu (stejně jako přímá vazodilatancia typu hydralazinu) mají efekt neutrální.
Beta-blokátory, zejména ß-blokátory neselektivní, bohužel inzulinorezistenci zvyšují. Proto jsou u rizikové populace (například u starších, obézních či dokonce u diabetiků) vhodné až do kombinace s metabolicky neutrálními léky či s blokátory osy RAA. Bohužel, díky podobnému mechanismu antihypertenzního účinku není aditivní efekt ß-blokátorů k inhibitorům ACE či k sartanům velký. Diuretika bychom neměli kombinovat s ß-blokátory, potencuje se totiž negativní metabolický účinek; naopak velmi výhodná je komedikace s inhibitory ACE či se sartany. Jako lék prvé volby proto volíme u diabetika či při vyšším riziku vývoje poruchy glycidového metabolismu (např. při obezitě či nepříznivé rodinné anamnéze) dlouhodobě působící inhibitor ACE či sartan. V přehledu je dopad antihypertenzív na základní regulační systémy v glukoregulaci uveden v Tab. 3.
¨
Inhibice systému renin-angiotenzin-aldosteron
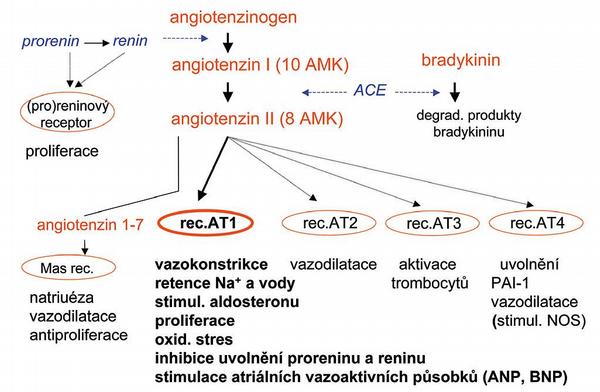
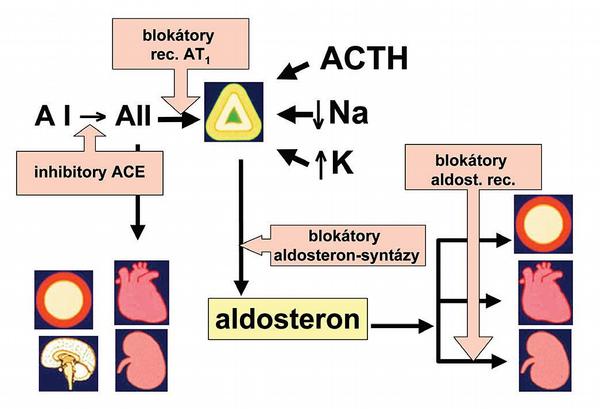
Systém renin-angiotenzin-aldosteron (RAA) je nejvýznamnějším mechanismem zajišťujícím rovnováhu mezi napětím cévní stěny a intravaskulárním plnícím tlakem, tj. rozhodujícími veličinami určujícími výši krevního tlaku. Vedle přímé kontroly tlaku zasahuje osa RAA a souběžné systémy (zejména systém kininový, natriuretických-vazodilatačních peptidů či angiotenzinu 1–7) do proliferačních a apoptotických procesů v cévní stěně, do metabolismu glycidů a lipidů a v neposlední řadě do trombogeneze a fibrinolýzy (Obr. 2).
Hlavním cílem při inhibici systému RAA je nepochybně snížení stimulace hlavních receptorů angiotenzinu II, tj. podtypu AT1. Nejvýše, tj. na úrovni výdeje a účinku reninu, blokují osu RAA ß-blokátory či inhibitory reninu. O krok níže, tj. na úrovni konverze AI na AII a degradace bradykininu, působí inhibitory angiotenzin konvertujícího enzymu. V periferii pak tlumíme systém blokátory receptorů AT1 čili sartany nebo aktivaci mineralokortikoidní složky blokátory aldosteronových receptorů.
Nepochybnou předností inhibitorů ACE je, že zvyšují nabídku bradykininu. Ač je bradykinin často vnímán pouze jako příčina nežádoucích účinků (angioedému – právem, či kašle – neprávem), skutečností je, že kininy zajišťují významnou složku farmakodynamického účinku. Bradykinin potencuje natriurézu i vazodilataci stimulací NO-syntázy i prostaglandin syntázy. Tímto způsobem zvyšuje nabídku dvou klíčových endoteliálních působků – oxidu dusnatého a prostaglandinu E2 – a upravuje funkci endotelu. Významná je také účast angiotenzinu 1–7 jako kontrolního systému tlumícího výsledný dopad nadměrné stimulace osy RAA. Ten se ve větší míře uplatní při užití sartanů, vysoká nabídka AII totiž vede k i k vyšší dostupnosti angiotenzinu 1–7.
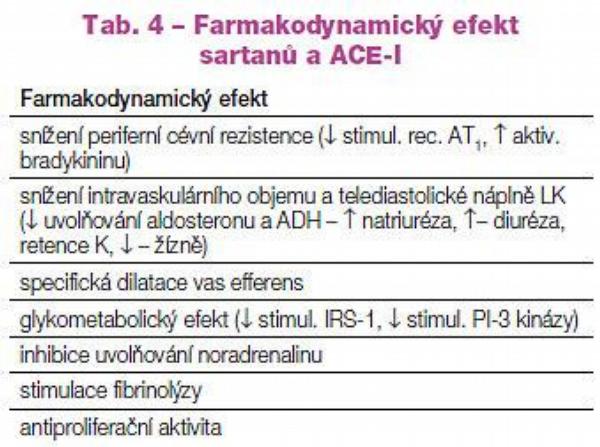
Také zapojení ostatních receptorů typu AT, zejména vazodilatačních AT2 a AT4, může být při endoteliální dysfunkci a hyperaktivaci zánětlivých pochodů v cévní stěně významné. Stimulace těchto receptorů je aktivována též při podávání sartanů. Blokáda aktivity reninu jeho přímými kompetitivními inhibitory neovlivňuje ani dostupnost bradykininu, ani aktivaci angiotenzinu 1–7 a receptorů Mas, ale vedle inhibice vlastní osy RAA též tlumí aktivaci výše popsaných (pro)reninových receptorů.(4–8) Mechanismus účinku inhibitorů ACE je komplexní. Hemodynamický účinek spočívá zejména v poklesu periferní cévní rezistence při vazodilataci a poklesu cirkulujícího volumu s nižší náplní cévního řečiště i s nižším plněním levé komory. Výsledkem je pokles krevního tlaku. Paralelně dochází v ledvině ke specifické dilataci vas efferens s následným snížením intraglomerulárního tlaku.
Tento pokles vede ke snížení případné proteinurie (například u diabetické nefropatie) a ke zpomalení degenerace glomerulů. Rubem však je, že zákonitě klesá glomerulární filtrace a mírně se snižuje glomerulární filtrační funkce ledvin (klesá renální clearence kreatininu). Neurohumorální účinek je dán inhibicí uvolňování aldosteronu a antidiuretického hormonu, což spolu s potlačením pocitu žízně v hypotalamu zamezuje retenci sodíku i vody. Pokles aktivity stimulace receptorů AT1 též snižuje aktivitu sympatoadrenální. Glykometabolický efekt inhibitorů ACE spočívá v potenciaci transmembranózního přesunu glukózy do skeletálního svalstva aktivací inzulín-senzitivního glukózového transportéru GLUT-4. Klinicky významný je i účinek na endotel. Zvýšení nabídky bradykininu i angiotenzinu 1–7 stimuluje NO-syntázu a zlepšuje endoteliální funkce: navodí vazodilataci, tlumí zánětlivé a degenerativní pochody v cévní stěně a v neposlední řadě má významný antitrombotický účinek (Tab. 4).
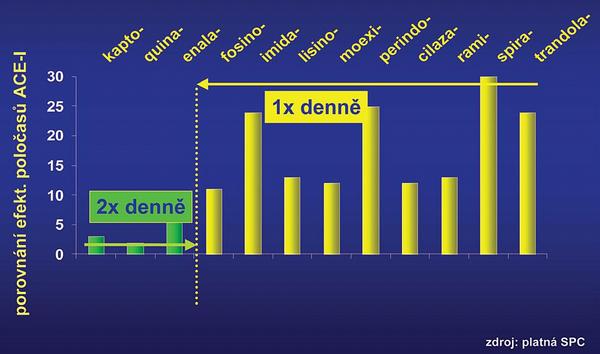
Inhibitory ACE je výhodné rozdělit podle délky účinku. Ke krátkodobě působícím řadíme kaptopril s délkou účinku 8–12 h a s nutností podávání 3krát denně, ke střednědobým enalapril a quinapril s délkou účinku 12–24 h s nutností podávání 2krát denně. Dlouhodobé (účinkující nejméně 24 hodin) jsou perindopril, ramipril, spirapril, trandolapril, cilazapril, dalapril, fosinopril, imidapril, lisinopril a moexipril. Délka efektu má výrazný dopad na klinický efekt. Na základě sledování prognózy je pravděpodobné, že dlouhodobě působící inhibitory ACE (zejména ramipril a perindopril) mají v rámci sekundární prevence či zachování funkce levé komory příznivější efekt na prognózu nemocných než střednědobé a krátkodobé (Quebecká analýza).(6) Relativní riziko úmrtí bylo při léčbě kaptoprilem, quinaprilem či fosinoprilem o více než 50 % vyšší než při terapii ramiprilem či perindoprilem.
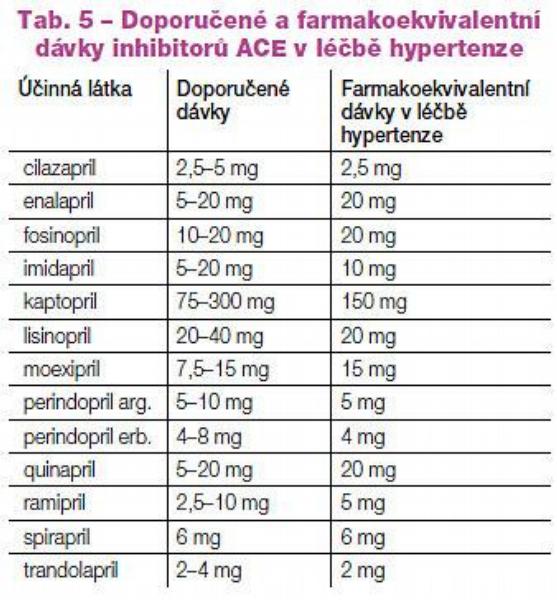
V indikaci léčby hypertenze je důležitá dostatečně dlouhá doba účinku umožňující léčbu v jedné denní dávce. Proto preferujeme inhibitory ACE dlouhodobé, optimálně perindopril, ramipril, či spirapril (Obr. 3). Způsob eliminace se ve skupině inhibitorů ACE mnoho neliší. Až na kaptopril s renální exkrecí se uplatňuje vyrovnaně renální i hepatální exkrece. Není proto ani nutno dávky při renální či hepatální nedostatečnosti redukovat. Dalším aspektem při výběru by měly být přidružené choroby a doklady o působení inhibitorů ACE v těchto indikacích. Pro léčbu hypertenze jsou v ČR registrovány všechny inhibitory ACE. Úlohu při výběru konkrétního léku hraje i výskyt nežádoucích účinků a riziko lékových interakcí. Prakticky však lze říci, že v toleranci inhibitorů ACE – jsou-li podávány ve farmakoekvivalentních dávkách – nejsou rozdíly. Rovněž riziko lékových interakcí na bázi farmakokinetiky je malé, farmakodynamické interakce jsou reprezentovány zejména symptomatickou hypotenzí při komedikaci s jinými antihypertenzívy.
Shrneme-li, pak z důvodů nejlépe doloženého klinického účinku, výhodných farmakologických vlastností i širokého terapeutického spektra je možno doporučit přednostně jeden z dvojice perindopril či ramipril. Farmakoekvivalentní dávky u nás dostupných inhibitorů ACE jsou uvedeny v Tab. 5.
Také mechanismus účinku blokátorů receptoru AT1 neboli sartanů je komplexní. Stejně jako u inhibitorů ACE spočívá hemodynamický účinek i antihypertenzní efekt především v poklesu periferní cévní rezistence a poklesu cirkulujícího volumu (Tab. 4). Srovnáme-li efekt obou skupin, pak vidíme, že mezi oběma skupinami není významnějších rozdílů, pouze inhibitory ACE mají v experimentu větší antihypertenzní účinek vyplývající z vyšší nabídky bradykininu a mají výraznější efekt na úpravu endoteliální dysfunkce.
Stejně jako u inhibitorů ACE-I patří i u sartanů léčba hypertenze k tradičním indikacím. Vzhledem k velmi příznivému dopadu léčby na ovlivnění prognózy nemocných s různými projevy aterosklerotického postižení a s diabetem (zejména s diabetickou nefropatií) či s hypertrofií levé srdeční komory by blokáda systému renin-angiotenzin neměla chybět v žádné kombinaci a v těchto situacích by měla být užita přednostně. V této indikaci patří sartany k lékům prvé volby. Do kombinační léčby je výhodné je podávat zejména s diuretiky a s BKK, kde blokáda osy RAA výrazně potencuje efekt diuretik a vzájemně se eliminuje efekt na vylučování či retenci draslíku. Výhody užití sartanů či inhibitorů ACE v léčbě hypertenze jsou shrnuty v Tab. 6.

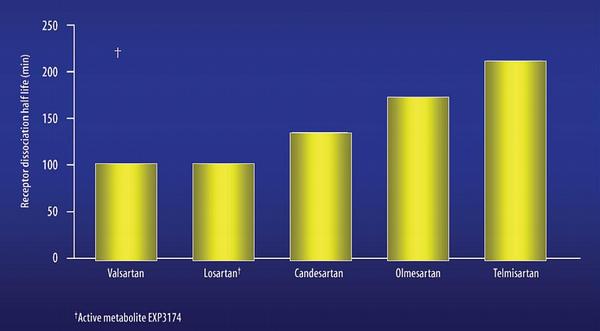
Též při výběru optimálního sartanu se řídíme farmakokinetickými a farmakodynamickými vlastnostmi. Z farmakokinetických vlastností se soustředíme na rozdíly v délce účinku: losartan má relativně krátkodobý efekt, proto musí být podáván optimálně ve dvou denních dávkách! Střední dobu účinku mají eprosartan a valsartan, nejdelší pak irbesartan, olmesartan, kardesartan a zejména telmisartan (Obr. 4, 5). Losartan je podáván ve formě proléčiva (prodrug), k jeho aktivaci jsou potřeba dvě oxidázy, CYP3A4 a CYP2C9. Při jejich inhibici (například antimykotiky, amiodaronem, makrolidovými antibiotiky, verapamilem či diltiazemem) pak hrozí selhání efektu při nedostatečné bioaktivaci. Ostatní sartany působí přímo bez nutnosti biokonverze. Na úrovni farmakodynamických účinků nejsou mezi sartany výraznější rozdíly.
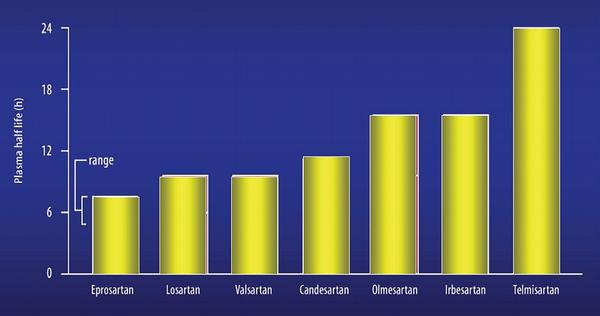
V současné době jsou u nás dostupné tři sartany – losartan, valsartan a telmisartan. Losartan má nevýhodu krátkého účinku, v druhé polovině 24hodinového intervalu je již efekt nedotrandolapril vyžadujeme proto podávání ve dvou denních dávkách. Valsartan, díky dobré vazbě na receptor, účinkuje po dobu 24 hodin a je možno akceptovat podávání v jedné dávce. Telmisartan má dlouhý plazmatický poločas i výbornou afinitu k receptoru, účinek proto přetrvává více než jeden den a pokryje dokonce i případné vynechání dávky. Další výhodou telmisartanu je doklad o příznivém ovlivnění prognózy normotenzních nemocných léčených z indikace sekundární prevence, tj. u nemocných s ICHS, po mozkových příhodách, s ICHDK či s diabetem provázeným orgánovými komplikacemi (studie ONTARGET).
Shrneme-li, pak inhibitory ACE i sartany jsou ideálními léky k léčbě hypertenze, mají dobře doložen efekt na prognózu nemocných s hypertenzí, mají optimální metabolické vlastnosti u diabetiků a u osob s vyšším rizikem cukrovky a jsou dobře snášeny (Tab. 7).
Kontraindikací obou skupin, inhibitorů ACE i sartanů, je v prvé řadě gravidita. Vzhledem k tomu, že blokáda systému RAA zasahuje nepříznivě do vývoje urogenitálního aparátu ve fázi metanefros, objevuje se teratogenní efekt až ve druhém trimestru. Proto neexistuje důvod vyhýbat se léčbě u nemocných žen v produktivním věku. Jen musíme důrazně upozornit, že v případě podezření na graviditu je nutno léčbu včas, tj. do konce prvého trimestru, přerušit.
V praxi je většina hypertoniků léčena kombinační léčbou. Jak optimálně inhibitory ACE či sartany kombinovat? Velmi výhodná je komedikace inhibitorů osy RAA s diuretiky thiazidové řady či s indapamidem. Léčba diuretiky totiž navodí volumovou depleci a snížení koncentrace natria, což je sledováno aktivací systému RAA. Obě skupiny tak působí synergisticky a lze dosáhnout výrazného snížení hypertenze, které je více než aditivní. Další vhodnou je kombinace s blokátory kalciového kanálu. Zde se uplatní převážně vazodilatační účinek obou skupin, což je nejvýhodnější u starších hypertoniků se zvýšenou periferní rezistencí s endoteliální dysfunkcí, s aterosklerotickým postižením a sníženou cévní poddajností. Tento typ hypertoniků je v praxi nejčastější. Kombinace inhibitoru ACE s blokátorem kalciového kanálu byla v klinické studii výhodnější než kombinace klasických antihypertenzív, tj. ß-blokátoru s diuretikem.(9)
Pro preferenci kombinace ACE-I s blokátory kalciového kanálu svědčí přesvědčivé výsledky studie ASCOT, kombinace amlodipinu s perindoprilem vedla k významnému snížení mortalitně/morbiditních ukazatelů proti thiazidovému diuretiku s ß-blokátorem. Největší efekt uvedené kombinace byl pozorován na poklesu KV úmrtnosti (24 %), iktu (23 %) a nového výskytu diabetu (32 %). Prakticky důležitou otázkou je kombinace inhibitorů ACE se sartany. Jaká jsou fakta? Rozsáhlá metaanalýza 14 randomizovaných studií sledujících efekt monoterapie a kombinace ACE-I se sartany dokumentovala pouze velmi malý přínos této duální léčby na vlastní pokles tlaku. Relativně nižší antihypertenzní odpověď je pozorována při kombinaci inhibitorů ACE či sartanů s ß-blokátory; antihypertenzní účinek blokátorů adrenergních receptorů ß je totiž dán též inhibicí výdeje reninu, tedy útlumem osy RAA, a výsledný účinek kombinace je tak méně než aditivní.
Blokáda účinku mineralokortikoidních, tedy aldosteronových receptorů je rovněž důležitou součástí strategie blokády osy RAA. Mineralokortikoidní receptory jsou druhými hlavními receptory zprostředkujícími efekt osy RAA. Sartany ani inhibitory ACE aldosteron neinhibují dostatečně. Vedle receptorů AT1 jsou totiž aldosteronové receptory pod vlivem chemoreceptorů a ACTH. Hyponatrémie nebo hyperkalémie či stres pak tyto receptory výrazně stimulují. Též je v rámci steroidogeneze známa řada polymorfismů či přímo enzymopatií, které jsou spojeny s mineralokortikoidní hyperaktivací a s hypertenzí. Proto je za řady situací, zejména u nemocných s rezistentní hypertenzí, se srdečním selháním či při hypokalémii, výhodné užití blokátorů aldosteronových receptorů. Antagonisté aldosteronových receptorů kompetitivně blokují periferní účinek aldosteronu na cytoplazmatických mineralokortikoidních receptorech (Obr. 6).
Během posledních dvou desetiletí jsme se dopracovali ke komplexnímu pojetí aldosteronu. Od koncepce mineralokortikoidu, podporujícího v nefronu směnu sodíku za draslík, dnes hledíme na aldosteron také jako na hormon působící na myokard i cévní stěnu, kde navozuje nežádoucí proliferaci fibroblastů. Inhibice tohoto posledního článku osy blokátory aldosteronových receptorů spironolaktonem či selektivněji eplerenonem má vedle antihypertenzního účinku i příznivý dopad na zpomalení degenerativních procesů v myokardu a ve stěně cévní.
V léčbě hypertenze je místo blokátorů aldosteronových receptorů zejména u nemocných s rezistentní hypertenzí nebo s hypertenzí při hyperaldosteronismu. Také u nemocných s hypokalémií je podání této skupiny léků výhodné. Vzhledem k vysoké ceně selektivního inhibitoru mineralokortikoidních receptorů – eplerenonu – je v těchto situacích podáván spironolakton. V dávkách 25 až 50 mg denně je přítomen efekt antiproliferační, ve vyšších dávkách (od 50 mg denně) navodí natriurézu a diurézu provázenou retencí kalia. Účelná je kombinace antagonistů aldosteronu s inhibitory systému RAA, tj. s inhibitory ACE či se sartany. Podávání samotných inhibitorů aldosteronových receptorů totiž hyperaktivuje vlastní osu RAA. Podávání nižších až středních dávek spironolaktonu u nemocných s restatečný, hypertenzí je v praxi často opomíjeno, ač je efekt v mnoha případech překvapivý a není omezen jen na pacienty s hyperaldosteronémií.(10) Posledním přírůstkem do rodiny inhibitorů RAA jsou přímé inhibitory reninu, recentně byl registrován prvý představitel skupiny – aliskiren.
Efekt aliskirenu je po farmakologické i klinické stránce velmi zajímavý. Jak bylo uvedeno, renin není pouze proteázou, ale také působkem stimulujícím cestou (pro)reninových receptorů hypertrofii svaloviny a proliferaci vaziva v cévní stěny či myokardu. Zatímco inhibitory ACE i sartany plazmatickou reninovou aktivitu zvyšují, inhibitory reninu ji tlumí. Potlačen je tak proliferační účinek reninu jako hormonu. Inhibitory reninu tak mají potenciál zabránit vývoji hypertrofie levé komory či navodit její regresi a snížit riziko remodelace cirkulární svaloviny arteriol a fixace zvýšené periferní rezistence. Na výsledném účinku se podílí útlum stimulace angiotenzinových receptorů i receptorů (pro)reninových. Antihypertenzní efekt aliskirenu v monoterapii byl srovnatelný s valsartanem, vzhledem k vyšší ceně však není aliskiren hrazen v indikaci léčby hypertenze.
Inhibice sympatoadrenální aktivity (ß-blokátory a α+ß-blokátory)
Na vývoji hypertenze se spolupodílí i sympatoadrenální hyperaktivace. S touto hyperaktivací se setkáme zejména v časnějších fázích vývoje hypertenze a u hypertenze u mladších osob s hypercirkulací. Hypercirkulace a stimulace vazokonstrikčních korových podnětů provázející aktivaci sympatiku se účastní na vzniku a udržení hypertenze. Proto u mladších hypertoniků patří sympatoadrenální inhibice k základním léčebným postupům. Podání ß-blokátoru zklidní sympatikotonii, sníží hypercirkulaci a upraví hypertenzi.
Naopak u starších osob (od 6. až 7. decennia) se podílí na vzniku a fixaci hypertenze zejména nadměrná vazokonstrikce se vzestupem periferní rezistence a snížení poddajnosti cévní stěny. Ta bývá vyjádřená zejména v magistrálních tepnách a vede ke vzniku izolované systolické hypertenze pružníkového typu. Tento typ hypertenze nebývá provázen výraznější sympatikotonií a po stránce hemodynamické je charakterizován naopak poklesem minutového srdečního výdeje. Proto podání ß-blokátorů u starších nemocných s nekomplikovanou hypertenzí nepatří k postupům prvé volby, snížení minutového výdeje není výhodné. Betablokátory přidáváme proto až do multikombinací antihypertenzív či je-li jiný důvod k jejich podání, jako je zejména tachykardie, event. tachyarytmie. Na druhé straně se sympatikotonie objevuje při koincidenci hypertenze s ischemickou chorobou srdeční, se srdečním selháním či s některými dysrytmiemi, event. může provázet i diabetes. Podání ß-blokátoru v těchto situacích by mělo být pravidlem.
Inhibice sympatoadrenálního systému můžeme dosáhnout na řadě úrovní. Na úrovni kůry působí například sedativa či anxiolytika. Tyto léky je výhodné užít u úzkostných hypertoniků a ve stresových situacích, zpravidla v kombinaci s antihypertenzívy základní řady. Na úrovni podkorových center působí i centrálně působící antihypertenzíva typu rilmenidinu, moxonidinu či urapidilu. Jejich mechanismus efektu je však komplexnější a snížení sympatikotonie nedosahuje úrovně dosažitelné ß-blokátory. Centrálně působící antihypertenzíva jsou výhodná u hypertoniků se známkami sympatikotonie (sklon k tachykardii, vegetativním projevům, psychické labilitě apod.). Výhodné jsou zejména, nemůžemeli podat ß-blokátory. Nejúplnější sympatoadrenální inhibice dosáhneme periferně účinkujícími ?+ß blokátory či ß-blokátory v kombinaci s ?-blokátory.
Mechanismus účinku ß-blokátorů spočívá v inhibici adrenergních receptorů ß, u kardioselektivních receptorů ß1 a u neselektivních ß1 i ß2 a částečně i ß3. Receptory ß1 v myokardu stimulují srdeční frekvenci, zrychlují vedení vzruchu a zvyšují stažlivost, v ledvinách stimulují vyplavení reninu. Receptory ß2 v hladké svalovině bronchů a cév navodí relaxaci a v játrech stimulují glykogenolýzu a glukoneogenezi. Méně významné receptory ß3 navodí v tukové tkání lipolýzu. Blokátory adrenergních receptorů α či α+ß působí i na druhou skupinu receptorů, tj. receptory jednoho z dvou podtypů receptorů α. Stimulace receptorů α1 navodí v hladké svalovině cévní stěny a genitourinárního traktu (zejména sfinkter močového měchýře) zvýšení tonu – kontrakci, v myokardu zvýší kontraktilitu a v játrech navodí glykogenolýzu.
Druhý typ – receptory α2 – stimulují v hladké svalovině cévní stěny kontrakci a v ß-buňkách pankreatu tlumí sekreci inzulínu. Shrneme-li, pak blokáda receptorů ß inhibuje výdej reninu, snižuje kontraktilitu a zpomaluje srdeční frekvenci. Snížení aktivity RAAS je provázeno poklesem krevního tlaku, navíc u mladších osob se může spolupodílet též útlum hypercirkulace. Řada betablokátorů bohužel zvyšuje periferní rezistenci, což zmenšuje vlastní antihypertenzní efekt. Metabolický účinek čistých ß-blokátorů je dán stimulací glykogenolýzy a navozením glukoneogeneze. Oba účinky zvyšují glykémii a přispívají k inzulinorezistenci. Naopak blokáda receptorů α snižuje periferní cévní rezistenci, stimuluje sekreci inzulínu a inhibuje glykogenolýzu, tedy glykémii snižuje. Karvedilol, blokátor receptorů α i ß, tak negativní metabolický efekt nemá a naopak citlivost k inzulínu zvyšuje. Rozdílné chování ß- a α+ß-blokátorů na glycidový metabolismus má význam při výběru blokátoru adrenergních receptorů u diabetiků.
Zásadním hlediskem při výběru ß-blokátoru jsou jeho farmakokinetické i farmakodynamické vlastnosti. Kardioselektivní blokátory (betaxolol, bisoprolol, metoprolol, atenolol či esmolol) zpomalují srdeční frekvenci i vedení vzruchu v převodním systému a snižují kontraktilitu myokardu; v ledvinách inhibují uvolnění reninu, což má rozhodující vliv na antihypertenzní účinek. Pro výběr ß-blokátoru mají význam též přídatné vlastnosti vedoucí různým mechanismem (např. blokádou receptoru ? u karvedilolu nebo nitrát-like účinkem u nebivololu) k vazodilataci.
Pro účinek a metabolismus jsou též důležité chemicko-fyzikální vlastnosti; rozeznáváme lipofilní a hydrofilní blokátory. Lipofilní molekuly pronikají snáze do CNS, což může vést občas k nespavosti, depresi a k poruchám sexuální aktivity. Celá skupina lipofilních blokátorů (zejména však metoprolol, nebivolol a karzistentní vedilol) jsou metabolizovány v játrech oxidázou CYP2D6. Díky polymorfismu tohoto enzymu se setkáváme s velmi proměnlivou hladinou těchto léků; v populaci máme vedle sebe ultrarychlé, rychlé, střední a pomalé metabolizátory. Frekvence jednotlivých skupin v populaci se pohybuje v procentech až v desítkách procent, interindividuální rozdíly v plazmatických hladinách i v délce účinku jsou u lipofilních blokátorů až desetinásobné.
Díky této klinicky významné variabilitě hladin i délce působení bychom v praxi měli upravovat dávku podle jednoduchého ukazatele účinku, tj. podle srdeční frekvence; optimální hodnoty pro rozhodující většinu nemocných jsou v rozmezí mezi 50–65 tepů/min. Naopak u hydrofilních ß-blokátorů (bisoprolol, betaxolol a atenolol), jejichž metabolismus je nezávislý na cytochromovém systému a které jsou vylučovány ledvinami, je diference nevýznamná. Rozdíly v klinickém účinku mezi oběma skupinami prokázány nebyly.(11) Při výběru ß-blokátoru má zásadní význam též délka účinku (Obr. 7).
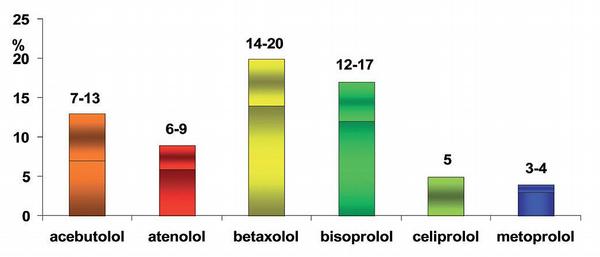
Dlouhodobě účinné (betaxolol, bisoprolol či metoprolol v retardované podobě ZOK) mají výhodu nejen v možnosti podávat je v jedné denní dávce, ale zajistí dostatečný účinek v době sympatikotonie v ranních hodinách, tedy i v době kulminace krevního tlaku a maxima výskytu koronárních příhod. Nutno důrazně připomenout nevhodnost užívat k léčbě hypertenze neretardované formy metoprololu či jiných krátkodobě účinných blokátorů.
Bisoprolol a betaxolol jsou výrazně kardioselektivní hydrofilní blokátory bez ISA (vnitřní sympatická aktivita); výhodou je dlouhý biologický poločas (t1/2 15–20 hodin), zajištěn je spolehlivý efekt po 24 hodin. Díky hydrofilitě mají nízký interakční potenciál, spolehlivý účinek a nižší výskyt nežádoucích účinků. Bisoprolol má velmi dobře dokumentován efekt v plejádě klinických indikací. Metoprolol je kardioselektivní blokátor, výrazně lipofilní bez ISA, v neretardované podobě má u většiny populace kratší biologický poločas (t1/2 3 h); proto je nutno trvat na užití retardovaných forem. Kvůli významným interindividuálním rozdílům v metabolismu je vhodné titrovat dávku. I když farmakokinetické ukazatele nejsou optimální, výhodou je jednoznačně prokázaný efekt v řadě kardiologických indikací.
Atenolol je středně kardioselektivní, výrazně hydrofilní bez ISA, středně dlouhá doba účinku (t1/2 6–9 h), která nezaručuje účinek po celých 24 hodin; podáváme proto vždy 2krát denně. Vzhledem k dostupnosti výhodnějších ß-blokátorů se však jeho volbě raději vyhneme. Celiprolol je kardioselektivní, hydrofilní blokátor s ISA; má středně dlouhý biologický poločas (6–8 hodin); proto preferujeme i zde podávání dvakrát denně. Předností je jeho vazodilatační účinek vyplývající ze stimulace receptorů ß2, pro indiferentní či dokonce mírně bronchodilatační efekt je výhodný k betalytické léčbě u nemocných s bronchiální obstrukcí a s astmatem. V indikaci léčby hypertenze u diabetiků jsou vhodné dva ß-blokátory – nebivolol a karvedilol, oba postrádají negativní metabolický efekt.
Jaký je současný názor na podávání ß-blokátorů v léčbě hypertenze? Po tři desetiletí patřila tato skupina mezi antihypertenzíva prvé volby. Nicméně v posledních letech se názory na podávání ß-blokátorů u starších nemocných s nekomplikovanou hypertenzí změnily. Posun nastal po metaanalýze výsledků řady hypertenzních studií a výsledku studie ASCOT. Ukázalo se, že zejména u starších hypertoniků s nekomplikovanou hypertenzí vedlo podávání ß-blokátorů (převážně byl ve studiích užíván atenolol) k menšímu poklesu výskytu cévních mozkových příhod než při užití antihypertenzív ze skupiny blokátorů systému RAA či blokátorů kalciového kanálu. Rozdíly ve výskytu infarktu myokardu prokázány nebyly, rovněž mortalita byla při léčbě ß-blokátory stejná, jako při užití modernějších antihypertenzív. Při srovnání ß-blokátorů s placebem pozitivní efekt na pokles mortality a morbidity zůstal, nicméně proti modernějším antihypertenzívům byl zejména účinek na pokles mozkových příhod méně přínosný.
Z kombinací výhodných pro užití s ß-blokátory je nutno uvést především blokátory kalciového kanálu thienopyridinového typu, optimálně amlodipin. Nevhodná je naopak kombinace s verapamilem či diltiazemem, které negativně ovlivňujících tvorbu a vedení vzruchu v myokardu. Tento negativně dromotropní a chronotropní efekt v kombinaci s ß-blokátory může vyústit v symptomatickou bradykardii či ve vyšší stupeň síňokomorového vedení. Komedikace ß-blokátoru s inhibitory systému RAA je sice možná, nicméně je nutno počítat s méně než aditivním účinkem; při blokádě systému se neuplatní účinek inhibice ß-receptorů na výdej reninu. Z druhé řady antihypertenzív je výhodná kombinace se všemi léky, přednostně však s přímými periferními vazodilatancii. Blokáda ß-receptorů zabrání nežádoucímu vzestupu srdeční frekvence, se kterou se u těchto léků setkáváme.
Shrneme-li, pak ß-blokátory v léčbě hypertenze preferujeme zejména do kombinační léčby; ß-blokátor by neměl chybět v léčbě mladších hypertoniků s hypercirkulací, hypertoniků se známkami sympatikotonie či při koincidenci hypertenze s tachyarytmiemi, u nemocných s ICHS, zejména u nemocných po infarktu myokardu, u nemocných s poruchou funkce levé komory či se srdečním selháním. Naopak u nemocných s metabolickým syndromem, u obézních či s poruchou glycidového metabolismu budeme indikaci ß-blokátoru zvažovat a přikloníme se k ní, jen pokud se nezdaří kontrolovat hypertenzi antihypertenzívy metabolicky příznivými, tj. ze skupiny inhibitorů osy RAA či blokátory kalciového kanálu. Do kombinační léčby se ß-blokátoru bránit nebudeme ani u diabetika, bude-li hypertenze komplikována přítomností ICHS, srdečním selháním, tachyarytmií či budou-li známky nadměrné sympatikotonie.
Nutno však pamatovat, že u takovýchto nemocných není vhodná primární kombinace ß-blokátoru s thiazidovým diuretikem; přednostně volíme modernější antihypertenzíva.
Při výběru konkrétního přípravku považuji pro nejvýhodnější farmakokinetické i farmakodynamické vlastnosti i pro dostatek klinických studií za optimální bisoprolol. Jeho výhodou je vysoká selektivita, dlouhá doba účinku, dobrá tolerance, nízký potenciál při lékových interakcích a malá interindividuální variabilita účinku. Alternativou bisoprolu je betaxolol s podobnými vlastnostmi, avšak méně dokumentovaným klinickým účinkem. Ze skupiny lipofilních ß-blokátorů má zdaleka nejvíce dokladů o spolehlivém efektu v různých indikacích metoprolol.
Jeho nevýhodou však je nutnost užití spolehlivě retardované formy, vysoká interindividuální variabilita účinku a potenciál k lékovým interakcím. Skutečností ale zůstává, že metoprolol je nejen u nás jedním z nejoblíbenějších ß-blokátorů. V léčbě hypertenze u diabetika je možné s výhodou užít metabolicky neutrální ?+ß-blokátor karvedilol nebo ß-blokátor s vazodilatační složkou nebivolol. U hypertenze komplikované bronchiální obstrukcí či přímo astmatem je výhodný celiprolol s ß2 mimetickou složkou. Při srdečním selhání volíme k léčbě hypertenze jeden z čtveřice – karvedilol, bisoprolol, metoprolol či nebivolol.
Blokátory kalciového kanálu
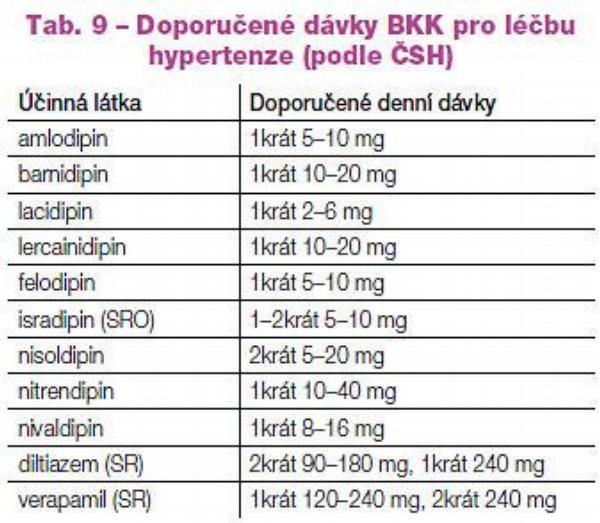
Blokátory kalciového kanálu (BKK), stejně jako diuretika, snižují krevní tlak nespecificky, tj. aniž by působily na definovaný regulační systém. Relaxací hladké svaloviny cévní stěny snižují periferní rezistenci. Navodí tak pokles tlaku nezávisle na mechanismu jeho vzestupu. Non-dihydropyridonové blokátory (verapamil i diltiazem) ovlivňují též tvorbu a vedení vzruchu v myokardu a snižují kontraktilitu myokardu. V léčbě hypertenze se uplatňuje v rozhodující míře efekt vazodilatační.
Mechanismus účinku je postaven na blokádě kalciových kanálů typu L. Tento typ kalciových kanálů je zejména v hladké svalovině cévní stěny, kde kontroluje tonus hladké svaloviny, tedy rezistenci, a v myokardu, kde řídí přesun vápníku přes sarkolemu, tedy kontraktilitu či vznik a vedení vzruchu.
Blokátory kalciového kanálu jsou heterogenní skupinou farmak, které se liší nejen chemickou strukturou, ale též farmakokinetickými (zejména délkou účinku) i farmakodynamickými vlastnostmi (ovlivněním tvorby a vedení vzruchu, kontraktility myokardu a vazodilatačním účinkem). I když mechanismus účinků je obdobný, kvůli určitým rozdílům mají jednotlivé BKK odlišné indikace, nežádoucí účinky a dokonce jsou rozdíly v dopadu na prognózu nemocných.
Farmakodynamický efekt dihydropyridinových BKK (amlodipin, barnadipin, felodipin, isradipin, lacidipin, lercainidipin, nifedipin, nimlodipin, nisoldipin, nitrendipin a nilvadipin) je omezen na vazodilataci na úrovni konduktivní i rezistenční části tepenného řečiště. Antihypertenzní efekt je dán převážně snížením periferní rezistence, ale i zlepšením poddajnosti velkých tepen. Druhý typ, non-dihydropyridiny (verapamil a v menší míře i diltiazem), mají, kvůli vazbě na kardiomyocyty a specializované buňky, navíc účinek negativně inotropní (snížení kontraktility), negativně chronotropní (zpomalení tvorby vzruchu v sinusovém uzlu) a negativně dromotropní (zpomalení vedení vzruchu). Efekt na buňky převodního systému umožňuje jejich užití též jako antiarytmik, naopak kardiodepresivní účinek přísně kontraindikuje jejich podání při srdeční nedostatečnosti. Z farmakokinetických vlastností je klinicky důležitá zejména rychlost nástupu a doba trvání účinku (Obr. 8, 9).
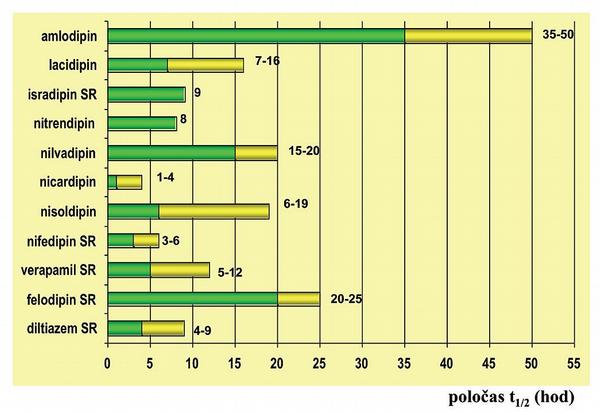
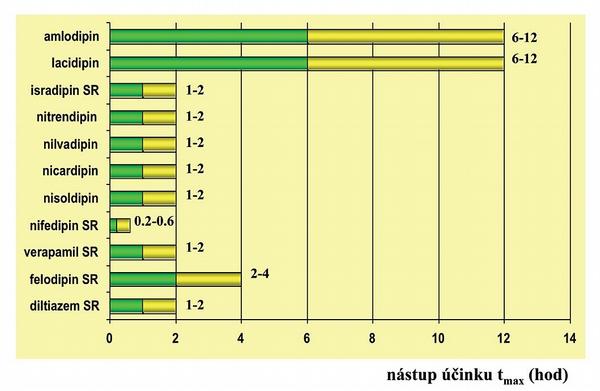
Při příliš rychlém navození vazodilatace dojde k poklesu tlaku a k nežádoucí aktivaci sympatoadrenálního systému. Vyplavení katecholaminů nejen sníží výsledný léčebný efekt (antiischemický a antihypertenzní), ale pravděpodobně je tato reakce zodpovědná za zhoršení prognózy nemocných léčených nifedipinem. Podobně příliš krátká doba účinku vede k oslabení či vymizení efektu před podáním další dávky, což vede k opakované sympatoadrenální aktivaci. Proto dáváme přednost déle působícím BKK s pomalým nástupem účinku a s dlouhým efektem. Zejména výhodný je z tohoto pohledu amlodipin (tmax je 6–12 h, t1/2 je 35–50 h), event. obdobně pomalý nástup účinku, ale kratší efekt mají též barbidipin, lacidipin či lercainidipin (tmax je 6–12 h, t1/2 je 6–10 h).
Dihydropyridinová řada BKK je metabolizována oxidázou CYP3A4, jejíž aktivitu neovlivňují. Komedikace s inhibitory CYP3A4 (amiodaron, antimykotika, některá makrolidová antibiotika, verapamil, diltiazem, grapefruitová šťáva aj.) může hladinu výrazně zvýšit a působení induktorů CYP3A4 (rifampicin, třezalka, fenobarbital aj.) může naopak působení výrazně omezit. U verapamilu a diltiazemu je situace komplikovanější: oba jsou substráty jak CYP3A4, tak transportního proteinu glykoproteinu P (P-gp) a oba metabolické systémy významně inhibují. Proto mohou klinicky významně zvýšit expozici organismu substráty CYP3A4, jejichž metabolismus zablokují. Významné je zvýšení hladin některých statinů, zejména simvastatinu a lovastatinu, makrolidových antibiotik, amiodaronu, steroidních hormonů a některých cytostatik.
Inhibice eliminačního systému P-gp verapamilem a diltiazemem významně zvyšuje hladinu digoxinu, která může dosáhnout až hladin toxických. Proto raději nekombinujeme verapamil ani diltiazem se simvastatinem, lovastatinem, digoxinem či se steroidními hormony, tedy ani s perorálními antikonceptivy. Blokátory kalciového kanálu je možné užít do kombinace se všemi ostatními antihypertenzívy, pouze verapamil a diltiazem nepodáváme či jen opatrně kombinujeme s ß-blokátory.(12) Máme-li k dispozici třináct různých blokátorů, který užít k léčbě hypertenze?
Předně musíme zajistit dostatečnou kontrolu tlaku v průběhu dne a vyloučit kolísání, které vede k zapojení regulačních mechanismů a vyplavení katecholaminů. Při srovnání s ostatními skupinami má nejvíce dokladů o účinku amlodipin. V kombinaci s perindoprilem má doložen příznivější dopad na pokles kardiovaskulárních příhod a mortalitu ve srovnání s diuretikem v kombinaci s ß-blokátorem. Navíc jeho farmakokinetické vlastnosti, tj. pomalý nástup účinku (6–12 hodin) a dlouhý poločas (35–50 hodin), spolu s vysokou biologickou dostupností a nízkým interakčním potenciálem, z něj činí optimální blokátor kalciového kanálu k léčbě hypertenze.
Diuretika v léčbě hypertenze
Poslední skupinou základní řady antihypertenzív jsou diuretika thiazidové řady (v ČR dostupný hydrochlorthiazid a chlorthalidon) a diuretika s vazodilatačním potenciálem (indapamid či metipamid). Jejich výhodou je výrazný antihypertenzní efekt, nízká cena a doklad o zlepšení prognózy zejména v léčbě starších nemocných se systolickou hypertenzí. Při užití vyšších dávek thiazidových diuretik se však můžeme setkat s nepříznivým účinkem na zhoršení glukózové tolerance, s deplecí draslíku a hořčíku, s hyperurikémií či s mírným zvýšením triglyceridémie. Metabolický účinek diuretik na snížení citlivosti k inzulínu vyplývá především z hyperaktivace RAAS při stimulaci výdeje reninu na podkladě stimulace volumo-, chemoi osmoreceptorů v juxtaglomerulárním aparátu.
Riziko metabolických změn v oblasti glycidového a lipidového metabolismu je nižší u indapamidu při zachování jeho antihypertenzního účinku. Naopak kličková diuretika (furosemid), která mají sice výraznější natriuretický a diuretický efekt, avšak krátkou dobu účinku, se k léčbě hypertenze užívají jen vzácně a ve specifických indikacích, jako u renálního selhání komplikovaného hypertenzí. Diuretika rozhodně patří mezi základní antihypertenzíva a pro jejich antihypertenzní potenciál by neměla chybět v kombinační léčbě, optimálně jako doplnění blokády systému RAA a blokátoru kalciového kanálu.(13) Mechanismus účinku thiazidových diuretik a indapamidu je v inhibici transportních iontových kanálů v distálním nefronu tubulu (Na+/Cl- ko-transport). Zde snižují zpětnou resorpci sodíku a druhotně i vody.
Výhodou thiazidových diuretik je především mírný a dlouhodobý antihypertenzní efekt daný poklesem natrémie (což vede k přímé relaxaci periferních arteriol) a snížením cirkulující tekutiny. Určitou nevýhodou podávání diuretik je hyperaktivace systému renin-angiotenzin-aldosteron, což snižuje antihypertenzní efekt a je v pozadí za nepříznivým metabolickým účinkem. Kombinace s inhibitory ACE či se sartany je proto velmi výhodná pro výraznou potenciaci antihypertenzního účinku a potlačení vlivu diuretik na inzulinorezistenci.
Výhodou diuretik je jejich dobrá snášenlivost, dostatečný průkaz o zlepšení prognózy léčených hypertoniků obecné populace i starších nemocných se systolickou hypertenzí.(13) Tato fakta, spolu s nízkou cenou, je předurčují k užití do kombinační antihypertenzní léčby. Předností je možnost výhodné kombinace se všemi ostatními antihypertenzívy. Nevýhodou thiazidů je selhání natriuretického a diuretického účinku při renální nedostatečnosti. Při kreatininémii nad 140 mmol/l proto volíme i při léčbě hypertenze opakovaně podávaný (tj. ve dvou až třech denních dávkách) furosemid. K léčbě hypertenze užíváme nižší dávky thiazidů, které mají jen malý negativní metabolický efekt (Tab. 10).
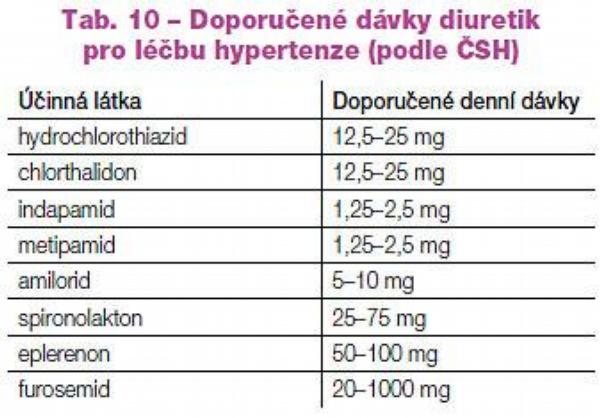
Je však nutné zdůraznit, že i tyto malé dávky mohou vést k depleci draslíku a hořčíku. Tato deplece může navodit život ohrožující arytmie a zvyšuje riziko náhlé smrti. Proto je výhodná kombinace s diuretiky šetřícími kalium (amilorid), s antagonisty aldosteronových receptorů (spironolakton), s inhibitory ACE či se sartany. Vlastní kalium-šetřící diuretika mají antihypertenzní účinek malý; využíváme je jen k odvrácení deplece kalia a magnézia při léčbě thiazidy či kličkovými diuretiky. Při léčbě diuretiky vždy kontrolujeme hladinu draslíku a hořčíku.
Při výběru antihypertenzíva, zejména u osob s diabetem či s rizikem jeho vzniku, nebudeme podávat diuretika jako lék první volby, ani je nebudeme přidávat ke stávající léčbě ß-blokátorem. Naopak zlatým standardem bude kombinace diuretika s blokátory osy RAA (inhibitoru ACE či sartanu) a blokátoru kalciového kanálu. Při volbě konkrétního léčiva je výhodný indapamid pro menší negativní metabolický efekt a nevelký přídatný účinek vazodilatační. Při volbě mezi hydrochloruthiazidem a chlorthalidonem zvolíme raději pomaleji a déle působící chlorthalidon, čímž zlepšíme toleranci léčby.
Na závěr nutno ještě jednou zdůraznit výhodu kombinace diuretik právě s inhibitory ACE či se sartany k potlačení aktivace RAAS, a tím i metabolického efektu diuretik. Neboť je to právě hyperaktivace systému, která je v pozadí za vznikem inzulinorezistence.
Antihypertenzíva druhé řady
Za antihypertenzíva druhé řady jsou označována nikoliv antihypertenzíva méně účinná, ale antihypertenzíva, která nemají jasně doložen efekt na zlepšení prognózy nemocných. Antihypertenzíva druhé řady jsou reprezentována centrálními sympatolytiky a vazodilatancii působícími přímo na cévní stěnu. Jejich místo je v kombinaci s antihypertenzívy základními. Navození vazodilatace u centrálně působících sympatolytik je dáno snížením periferní aktivity sympatiku po stimulaci centrálních receptorů α2 (metyldopa) či centrálních imidazolinových receptorů (rilmenidin a moxonidin). Stimulace obou typů receptorů má srovnatelný antihypertenzní účinek, nicméně aktivace imidazolinových receptorů je provázena nižším výskytem nežádoucích účinků (sedace) a nehrozí riziko rebound fenoménu. Přímá periferní vazodilatancia (endralazin, dihydralazin a minoxidil) působí blíže neurčeným způsobem přímo arteriolodilataci s výrazným poklesem periferní rezistence. Tento pokles bývá bohužel provázen reflexní tachykardií, zvýšením metabolických nároků myokardu a snížením koronární perfúze. Proto bychom měli vždy kombinovat přímá vazodilatancia s ß-blokátory.
Zavedení modernějších dobře tolerovaných přípravků (zejména moxonidinu, rilmenidinu a urapidilu) vedlo k určité renesanci antihypertenzív s centrálním či periferním působením na podkladě ovlivnění receptorů α, receptorů serotoninových nebo receptorů imidazolinových. Na adrenergní receptory typu α můžeme působit na několika úrovních. Stimulace v oblasti vazomotorického centra v CNS či stimulace periferních presynaptických receptorů (podtyp α2) je spojena s vazodilatací. Obdobně je s vazodilatací spojena periferní blokáda postsynaptických adrenergních receptorů podtypu α1. Na jedné úrovni (centrálně) je vazodilatace navozena stimulací, na straně druhé (v periferii) je stejného efektu dosaženo blokádou adrenergních receptorů α. Místem centrálně působících přípravků je vazomotorické centrum v prodloužené míše. Tato oblast je citlivá nejen na katecholaminy, ale též na látky s imidazolinovou strukturou (přirozený ligand nebyl zatím určen).
Moxonidin a rilmenidin navodí stimulaci imidazolinových receptorů ve vazomotorickém centru prodloužené míchy, čímž výrazně snižují sympatickou aktivitu: klesá periferní rezistence, klesá výdej reninu a vazopresinu. Oba léky mají relativně málo nežádoucích účinků, jsou proto výhodné do kombinací po vyčerpání základní řady antihypertenzív. Zejména dobrý efekt na pokles tlaku byl zaznamenán u osob s psychickou excitovaností. Metyldopa působí jako falešný neurotransmiter stimulující centrální receptory α. Vzhledem ke krátkému účinku je nutná aplikace dvakrát až třikrát denně. Výhodou je bezpečnost v graviditě. Klonidin stimuluje jak α2-receptory, tak i imidazolinové receptory. V parenterální formě je vhodný k léčbě hypertenzní krize.
Neprávem opomíjené antihypertenzívum působící centrálně i periferně je urapidil. Díky snížení periferní rezistence blokádou postsynaptických receptorů α v mozku potlačuje aktivitu sympatiku stimulací serotoninových receptorů. Tato kombinace centrálního i periferního působení vede k potlačení nežádoucích účinků typických pro přímé dilatátory a proti centrálně působícím antihypertenzívům je akcentován efekt na snížení tlaku. V nitrožilním podání je vhodný k léčbě hypertenzních krizí, v perorální formě (optimálně v retardované podobě) do kombinace se základní řadou antihypertenzív. Pokles tlaku po přidání urapidilu je často překvapivý.
Periferně působící antihypertenzíva typu blokátorů postsynaptických receptorů ?1 mají dvojí klinické užití. Vedle léčby hypertenze jsou indikovány k symptomatické léčbě poruch vyprazdňování močového měchýře při benigní hyperplazii prostaty. Jako antihypertenzív je jejich užití u nás omezeno indikačním omezením, nicméně v léčbě rezistentních hypertenzí je jejich přínos neocenitelný. Jejich výhodou v léčbě hypertenze u diabetika je i zlepšení inzulínové rezistence. Vždy je podáváme pouze do multikombinací se základními antihypertenzívy.
Do této skupiny léčiv jsou řazena antihypertenzíva ze skupiny ?-sympatolytik blokující postsynaptické receptory α1 (prazosin, doxazosin, terazosin) a antihypertenzíva blokující receptory α a ß (labetalol, carvedilol). Periferní α1-sympatolytika působí vazodilatačně, jejich podání snižuje periferní rezistenci a zvyšuje minutový srdeční objem. Po aplikaci první dávky se může dostavit krátkodobý prudký pokles krevního tlaku (fenomén první dávky), terapii je proto vhodné zahajovat co nejnižší dávkou aplikovanou na noc. Pokud je třeba přerušit podávání α1-sympatolytik (byť jen na několik dnů), je nezbytné při opětovném zahájení terapie tento postup zopakovat. Úloha ?-blokátorů je nezastupitelná v kombinační léčbě rezistentní hypertenze.
Kombinační léčba antihypertenzívy
Se zpřísněním cílových hodnot kontroly hypertenze je stále více nemocných léčeno kombinací antihypertenzív. Je to trend jistě žádoucí. Kombinování různých skupin léků umožní snížit dávku jednotlivých léků, což vede k lepší toleranci a ke snížení nákladů na léčbu. Vhodným výběrem docílíme zvýšení efektu, který vede k dosažení optimálních hodnot krevního tlaku u většího procenta nemocných. Při výběru léků do kombinace musíme především vycházet z jejich mechanismu účinku. Tak se snažíme zamezit kontraproduktivní aktivaci regulačních mechanismů (zejména sympatoadrenální a systému renin-angiotenzin) a dosáhneme plného efektu. U mírné hypertenze vystačíme většinou s monoterapií či s dvojkombinací.
U středně závažné a těžší hypertenze však bude troj- a multikombinace pravidlem. Ve specializovaných hypertenzních ambulancích není u těžkých forem choroby zdaleka výjimkou kombinace pěti i více léků. Analýza řady antihypertenzních studií, ve kterých bylo k dosažení cílového tlaku 130/85 mmHg zapotřebí snížit diastolický tlak v průměru o 17 mmHg, byla užita 2–4 antihypertenzíva. Zevšeobecníme-li tuto analýzu, pak v kombinační léčbě můžeme počítat s tím, že přidání dalšího antihypertenzíva nám sníží diastolický tlak o 5–10 mmHg. U systolického tlaku je odpověď vyšší, pokles tlaku je kolem 10–15 mmHg. Dnes, kdy trváme na ještě přísnější kontrole hypertenze, je nutno počítat s multikombinacemi.
Jako antihypertenzívum prvé volby u esenciální hypertenze bychom měli volit jednu z možností inhibice systému RAA, tedy sartan či inhibitor ACE. Do kombinace pak přednostně blokátor kalciového kanálu dihydropyridinové řady s pomalým nástupem účinku a dlouhodobým efektem – optimálně z třetí generace BKK, například amlodipin. Nedocílíme-li poklesu tlaku k cílovým hodnotám, je optimální přidat diuretikum, optimálně indapamid či chlorthalidon v kombinaci s kalium-šetřícím diuretikem (zejména s amiloridem). Teprve jako další lék volíme ß-blokátor, u diabetika lépe α+ß-blokátor karvedilol. Je-li některá skupina kontraindikována či intolerována nebo nedosáhneme-li stále cílových hodnot, pak je alternativou podání spironolaktonu, periferního α-blokátoru (například prazosinu) nebo centrálně či duálně působících antihypertenzív druhé řady (rilmenidinu, moxonidinu nebo urapidilu).
Při rozhodování o výběru antihypertenzíva hraje jistě úlohu přítomnost přidružených chorob. Současná přítomnost ICHS, zejména stavu po infarktu myokardu, upřednostňuje volbu inhibitoru ACE či sartanu s ß-blokátorem, při angině pectoris též s blokátorem kalciového kanálu. Je-li přítomna srdeční nedostatečnost, je postup obdobný, jen preferujeme inhibitor ACE, a není-li kontraindikací, pak místo ß-blokátoru (konkrétně bisoprololu či metoprololu) upřednostníme α+ß-blokátor karvedilol. Při nefropatii (zejména diabetické) by neměla chybět léčba inhibitorem ACE, někdy dokonce spolu se sartanem. Dostupné studie v této jediné indikaci dokumentují aditivní efekt obou lékových skupin. U různých typů tachyarytmií volíme z ß-blokátorů, event. se může uplatnit verapamil. Konečně u mužů s poruchou vyprazdňování močového měchýře při benigní hyperplazii prostaty je výhodné jako jedno z antihypertenzív volit ?-blokátor. Určitým problémem je výběr antihypertenzíva při erektilní dysfunkci. Obecně dobré zkušenosti jsou s blokátory kalciového kanálu, s inhibitory ACE či se sartany a z ß-blokátorů s těmi s maximální selektivitou, tj. zejména s bisoprololem. Naopak nejsou vhodná diuretika, centrálně působící antihypertenzíva či nedostatečně selektivní karvedilol.(14)
Ovlivnění životosprávy
Nedílnou součástí léčby hypertenze jsou zásahy do životosprávy. Vysvětlíme nemocnému potřebu redukce nadváhy, zvýšení fyzické aktivity, zanechání kouření a dietní opatření. Jaký můžeme očekávat efekt při zásahu do životosprávy? Dietní opatření (přednost zelenině a omezení příjmu saturovaných tuků, sodíku a alkoholu) vede k poklesu TK o 10–20 mmHg. Snížení hmotnosti, resp. optimalizace váhy, je sledováno poklesem TK o 5–20 mmHg na každých 10 kg redukce nadváhy. Zvýšení fy
zické aktivity (minim. 30 min chůze denně) redukuje TK o 5–10 mmHg.
U nemocných s vyšším normálním tlakem či s hraniční hypertenzí režimovými opatřeními často dosáhneme optimalizace tlaku. V praxi se však daleko častěji setkáváme s potřebou snížit tlak daleko více, než můžeme očekávat od úpravy životosprávy. V rozhodující většině případů proto volíme již od počátku farmakoterapeutický přístup a režimová opatření jsou jen jedním kamínkem v mozaice komplexního přístupu.
O autorovi: Prof. MUDr. Jan Bultas, CSc.
Univerzita Karlova v Praze, 3. lékařská fakulta, Ústav farmakologie
e-mail: jan.bultas@lf3.cuni.cz











