Souhrn
Materiál vyšetřujeme mikroskopicky, kultivačně a sérologickými metodami na průkaz komponent buněčné stěny hub. V článku je hodnocen přínos jednotlivých metod a úskalí interpretace získaných výsledků. Podrobně je probrána problematika stanovení antigenu aspergilů galaktomananu v bronchoalveolární tekutině metodou ELISA (Platelia Aspergillus, BioRad, Francie). Na základě výsledků studií je doporučeno hodnotit výsledek detekce galaktomananu v bronchoalveolární tekutině jako pozitivní při hodnotě indexu pozitivity ? 1 a při interpretaci zohlednit možnost falešné pozitivity při kolonizaci dýchacích cest vláknitými houbami a falešné negativity při podávání antimykotické léčby. Dolní dýchací cesty nejsou primárně sterilní lokalitou, proto je diagnóza stanovená na základě mykologického vyšetření bronchoalveolární tekutiny vždy pouze na úrovni tzv. diagnózy pravděpodobné podle kritérií EORTC/MSG.
Summary
Mallátová, N. Mycological examination of bronchoalveolar fluid
Invasive fungal diseases in immunocompromised patients are most frequently caused by yeasts of Candida genus and filamentous fungi of Aspergillus genus, less often by fungi of Mucorales order and Fusarium genus. Bronchoalveolar fluid is relatively accessible clinical material enabling diagnosis of lower respiratory tract infections. We examine this material microscopically, through cultivation and serological methods to detect components of fungal cell walls. This article evaluates the benefits of individual methods and pitfalls of results interpretation. The issue of Aspergillus Galactomannan antigens determination in bronchoalveolar fluid by ELISA (Platelia Aspergillus, Bio-Rad, France) is discussed in detail. Based on studies results it is recommended to evaluate the outcome of Galactomannan detection in bronchoalveolar fluid as positive when the value of positivity index is ? 1 and to take into account the possibility of false positivity in respiratory tract colonization by filamentous fungi and false negativity in administration of antifungal treatment during this interpretation. Lower respiratory tract is not a sterile site primarily, that's why the diagnosis is determined on the basis of bronchoalveolar fluid mycological examination always only at the level of so-called probable diagnosis by the criteria of EORTC/MSG.
Invazívní fungální onemocnění (Invasive Fungal Disease – IFD) jsou narůstajícím problémem u imunosuprimovaných pacientů. Vzrůstající trend IFD je zapříčiněn několika faktory. Základním je stále se zvyšující úroveň léčebné péče, a tím narůstající počet pacientů vystavených agresivní léčbě vedoucí ke snížení obranyschopnosti organismu a rozvoji houbové infekce. Nejvíce postiženou skupinou jsou nemocní s hematologickými malignitami, zvláště pak pacienti podstupující transplantaci krvetvorných tkání. Jednoznačně nejčastějším vyvolavatelem IFD jsou kvasinky rodu Candida a vláknité houby rodu Aspergillus, vzácněji plísně z třídy Zygomycetes nebo rodu Fusarium či Scedosporium. Infekce vláknitými houbami je nejčastěji lokalizována v plicích, naproti tomu kandidové infekce plic jsou poměrně vzácnou záležitostí. Plicním onemocněním se manifestuje také pneumocystóza, jejíž incidence se u hematoonkologických pacientů výrazně snížila díky dobře vedené profylaxi, a endemické mykózy – histoplazmóza, blastomykóza, kokcidioidomykóza a parakokcidioidomykóza. Ty postihují imunosuprimované pacienty hlavně ve střední a jižní oblasti USA a v Latinské Americe, v našich klimatických podmínkách se nevyskytují.
Základním komplikujícím momentem v diagnostice IFD postihujících plíce je fakt, že původci těchto onemocnění jsou ubikvitární saprofyté, kteří mohou běžně kolonizovat dýchací cesty v případě vláknitých hub, nebo v případě kvasinek jsou součástí naší endogenní flóry. Vzhledem k nejednoznačným klinickým symptomům a ne zcela specifickým nálezům ze zobrazovacích metod byla EORTC/MSG (European Organization for Research and Treatment of Cancer/Mycoses Study Group) stanovena diagnostická kritéria, podle kterých je diagnóza IFD označovaná jako jistá, pravděpodobná nebo možná. Za jistou je diagnóza považována pouze tehdy, máme-li histologický či mikroskopický průkaz houby z infikované tkáně získané invazívními technikami nebo kultivační průkaz ze sterilních lokalit vykazujících klinické či radiologické známky infekce.(1) Invazívní techniky odběru infikované tkáně jsou prováděny vzhledem ke svému riziku, zvláště u hematologických pacientů, vzácně. Proto mezi relativně nejdostupnější materiály z dolních dýchacích cest patří bronchoalveolární tekutina. Dolní dýchací cesty nejsou sterilní lokalitou, proto diagnóza stanovená na základě výsledků mykologického vyšetření z BAT je tzv. diagnóza pravděpodobná a nález je třeba vždy hodnotit v souvislosti s klinickými projevy a predispozičními faktory hostitele.
Bronchoalveolární laváž
Bronchoalveolární laváž (BAL) je metoda umožňující získat bronchoalveolární tekutinu (BAT) obsahující buněčné i nebuněčné složky z dolních dýchacích cest a na základě jejich vyšetření stanovit etiologii plicních onemocnění. Zvláštní indikací je určení původců zánětlivých plicních onemocnění u imunosuprimovaných pacientů. Flexibilní bronchoskop je zaváděn do oblasti, která ventiluje infikovanou oblast. Standardně jsou instalovány 3–4 porce (20–50 ml) sterilního fyziologického roztoku. Materiál k vyšetření lze získat i odsátím.(2) První porce a odsátý materiál jsou z okolí instalovaného instrumentária. Pro mykologické vyšetření je vhodnější porce druhá nebo event. třetí, která by měla obsahovat složky z alveolárních prostor. Bohužel nelze jednoznačně zabránit kontaminaci získané tekutiny, nejčastěji bakteriální flórou z orofaryngeální oblasti. Při analýze mikrobiologických nálezů z 246 tekutin z BAL od 197 hematologických pacientů s febrilní neutropenií bylo 23 % nálezů následně vyhodnoceno jako kontaminace nebo kolonizace.(3) Vyšší pravděpodobnost získání sterilního materiálu by měla být při provedení tzv. chráněné BAL (PBAL), kdy lze provést i kartáčkový stěr (PSB) z infikované lokality, pokud je bronchoskopicky dostupná. Boersma et al. porovnávali výtěžnost klasické BAL s chráněnými metodami u 53 pacientů s hematologickými malignitami a dospěli k závěru, že výsledky získané z BAL jsou srovnatelné s výsledky získanými z PBAL a PSB a provedení BAL je jednodušší a levnější.(4) Je jednoznačné, že vyšší záchytnost můžeme očekávat, provádí-li se BAL systematicky, např. po třech dnech trvající febrilní neutropenii bez reakce na antibiotickou léčbu a na základě nálezu ze zobrazovacích metod.(5) V klasické mykologické laboratoři je BAT vyšetřena mikroskopicky, kultivačně a sérologickými metodami na průkaz komponent buněčné stěny hub (antigeny). Průkaz pomocí PCR metod bývá prováděn v laboratořích molekulární biologie.
Mikroskopie z BAT
Mikroskopické techniky dovolují ve velice krátkém čase získat rychlou orientaci v dodaném materiálu. Pomohou nám stanovit validitu zaslaného materiálu, přítomnost zánětu podle množství leukocytů, odhalí event. kontaminaci bronchoalveolární tekutiny bakteriální flórou dutiny ústní a v případě pozitivního nálezu mohou i velice rychle odhalit původce onemocnění. Senzitivita mikroskopického vyšetření je však nízká a v mnoha případech není ani dostatečně specifické. Preparáty barvíme metodou podle Grama, GiemsyRomanovského nebo Gram-Weigerta, často používaná jsou v mykologické laboratoři i fluorescenční barvení. Pro průkaz kryptokokových infekcí lze použít barvení tuší (podle Buriho). Barvení podle Grocotta je vyhrazeno spíše histologům. Mykotické elementy však pozorovat i v nativním preparátu (Obr. 1) nebo v preparátu s přídavkem 20% KOH. Kvasinky vidíme jako tenkostěnné kulaté nebo oválné buňky, často pučící nebo tvořící pseudomycelia, což je považováno za projev invazivity.
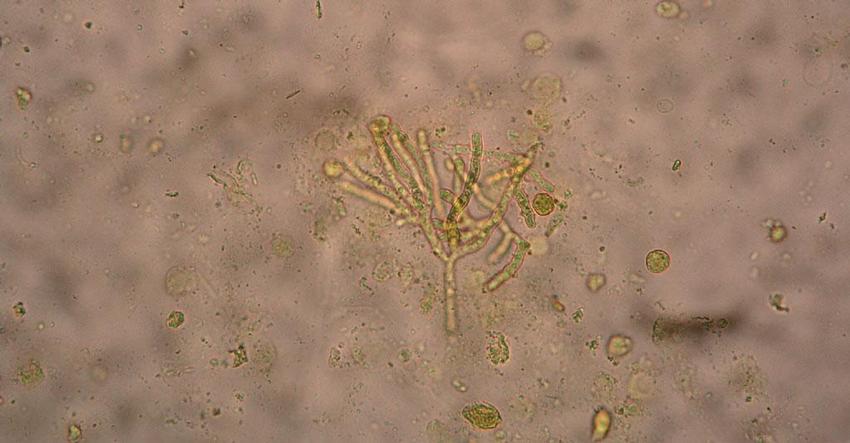
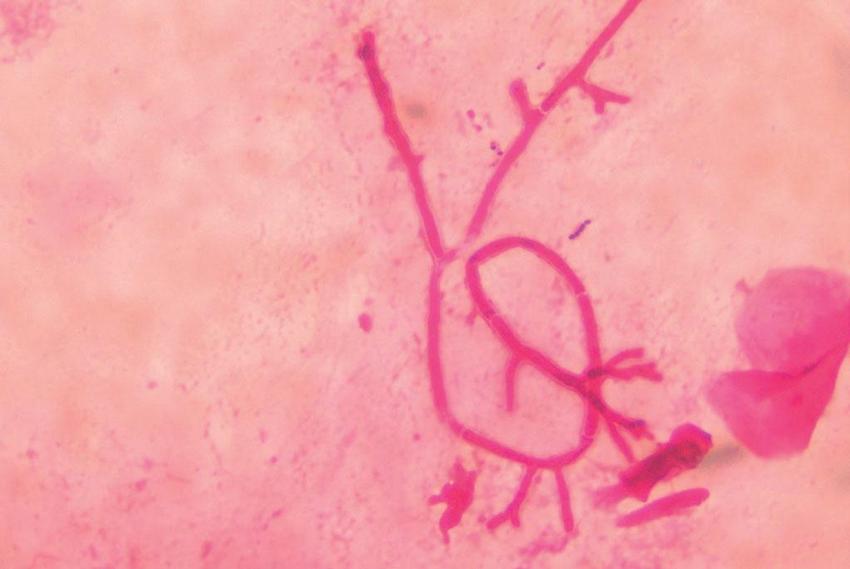
Hyfy vláknitých hub nejsou specifické, přesto pro aspergily jsou typická septovaná vlákna větvená do tvaru písmena V (dichotomické větvení) (Obr. 2), zygomycety mají vlákna neseptovaná, široká, s téměř pravoúhlým větvením, v anglické literatuře bývají přirovnávány ke zmačkané stuze. Pro diagnostiku Pneumocystis jiroveci je mikroskopie spolu s PCR základní diagnostickou metodou, houba není prokazatelná kultivačně. Pneumocystóza je u pacientů s hematologickými malignitami poměrně vzácná. Kontoyiannis et al. udávají v prospektivní studii z let 2001–2006 zahrnující 23 transplantačních center v USA incidenci 2 %, Pagano et al. v 10letém sledování pacientů s akutní leukémií v hematologických centrech Itálie 0,5 %.(6, 7) Podle Procopa et al. má nejvyšší senzitivitu i specificitu barvení podle Papanicolaou.(8) V ČR laboratořích se barví metodou GiemsaRomanovski na přítomnost trofozoitů, podle Grocotta či GramWeigerta, event. toluidinovou modří na přítomnost cystických stadií.(9) K dispozici je i komerční souprava využívající fluorescenční barvení.
Kultivace z BAT
Kultivace je základem mykologického vyšetření. Umožní izolaci, identifikaci mikromycety a následně i stanovení citlivosti k antifungálním látkám. Mikromycety se kultivují na Sabouraudově glukózovém agaru, event. s přídavkem antibiotika k potlačení růstu bakteriální flóry. Rostou však dobře na většině kultivačních půd a vzhledem k ubikvitárnímu charakteru bývají plísně, zvláště aspergily, častou kontaminantou v mikrobiologických laboratořích, což je třeba mít na paměti při hodnocení kultivačního nálezu. Kvasinky identifikujeme na základě jejich růstových a biochemických vlastností, pro identifikaci plísní je rozhodující jejich mikromorfologie. Nárůst kvasinek můžeme očekávat za 24–48 hodin. Plísně rostou pomaleji, nejdříve se objevují zygomycety a aspergily (2–5 dní). Kultivaci ukončujeme za 7–14 dní. U klinicky závažných houbových izolátů stanovujeme citlivost k antimykotikům kvantitativními metodami, to znamená metodami umožňujícími určit minimální inhibiční koncentraci (MIC). Pro testování citlivosti kvasinek je na našem trhu k dispozici podle standardu CLSI (Clinical Laboratory Standard Institute) připravený test Sensititre YeastOne (Trek diagnostika, USA) nebo Micronaut – AM (Merlin, Německo) umožňující kvantitativní mikrodiluční metodou stanovit MIC pro všechna antimykotika používaná v současné době k léčbě systémových mykóz. Další standardizovanou metodou vhodnou pro testování citlivosti kvasinek i vláknitých hub jsou tzv. Etesty (bioMérieux, Francie).
Kvasinky
Nejčastěji izolovaným houbovým agens z dýchacích cest jsou kvasinky z rodu Candida. Ve studii ARTEMIS bylo v letech 1997– 2005 identifikováno téměř 40 tisíc izolátů kvasinek z dýchacích cest. 70 % izolátů činila C. albicans, dalších 20 % C. glabrata a C. tropicalis.(10) U pacientů s hematologickými malignitami je však v posledních letech pozorován zřetelný posun od C. albicans k non-albicans druhům, zvláště ke C. glabrata a C. krusei, které jsou často resistentní k flukonazolu hojně využívanému v profylaxi u těchto pacientů.(11, 12) Kultivační či mikroskopický průkaz kandid z BAT však neznamená invazívní kandidovou infekci plic, vzhledem k tomu, že jsou kvasinky běžnou součástí naší endogenní flóry a dýchací cesty jsou kandidami kolonizovány. Udává se, že na JIP má 20 % pacientů kolonizováno dýchací cesty kandidami do 48 hodin po přijetí.(13) Vzhledem k nespecifickému klinickému obrazu i nejednoznačnému nálezu ze zobrazovacích metod je možné stanovit diagnózu kandidové pneumonie jednoznačně pouze histologicky z infikované tkáně. Obecně je přijímáno, že výskyt kandidové pneumonie je relativně nízký. Pasqualotto udává incidence kandidové pneumonie mezi 0,23 % až 4 %.(14) V prospektivní studii s ventilovanými pacienty na JIP byly kandidy kultivačně prokázány z plic ve 40 % případů, kandidová pneumonie byla však potvrzena pouze u 8 % pacientů.(15) Kami et al. analyzovali post mortem získané vzorky od 720 pacientů s hematologickými malignitami a v 9 % případů prokázali v rámci systémové kandidózy invazi plicní tkáně kandidou.(16)
Vzácně bývají z BAT izolovány kvasinky rodu Cryptococcus, Trichosporon, Geotrichum nebo Saccharomyces. Kontoyiannis udává incidenci kryptokokových onemocnění u pacientů s HSCT 0,6 %, incidenci non-Candida kvasinek 2 %.(6) Vláknité houby Jednoznačně nejčastějším vyvolavatelem IFD jsou vláknité houby rodu Aspergillus. Ve studii Kontoyiannise et al. bylo sledováno 16 200 pacientů po transplantaci kmenových buněk krvetvorby (HSCT – hematopoietic stem cell transplantation) z 23 transplantačních center v USA. V souboru bylo diagnostikováno 983 IFD, z nich tvořila invazívní aspergilóza 43 %, zygomykóza 8 % a fusarióza 3 %. Z rodu Aspergillus byl nejčastějším vyvolávajícím druhem Aspergillus fumigatus (44 %) (Obr. 3), dále A. niger 9 % (Obr. 4), A. flavus 7 %, A. terreus 5 % (Obr. 5). Sedm procent původců IFD tvořily tzv. ostatní plísně, mezi nimi byly zahrnuty rody Acremonium, Alternaria, Bipolaris, Chrysosporium, Cladophialophora, Curvularia, Exophiala, Exserohilum, Microascus, Paecilomyces, Penicillium, Phialemonium, Pseudallescheria, Scedosporium, Scopulariopsis a Trichoderma.(6) Pagano et al. udávají v období 1999–2003 celkovou incidenci IFD u 11 802 pacientů s hematologickými malignitami v italských univerzitních nemocnicích 4,6 %. Více než polovinu (2,9 %) tvořily infekce vyvolané vláknitými houbami, z toho 90 % byly aspergilózy, 4 % zygomykózy a 4 % fusariózy. Ojedinělé byly infekce vyvolané Scedosporium spp., Acremonium spp., Cladosporium spp. a Penicillium spp.(17)
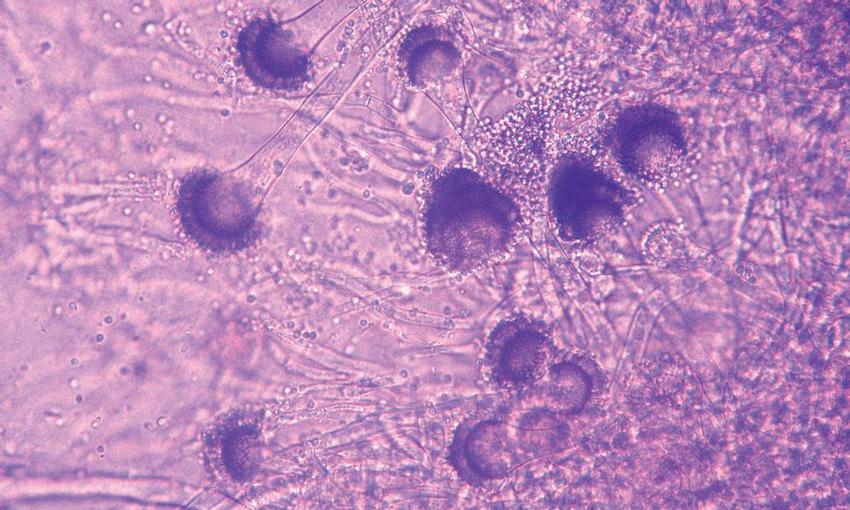
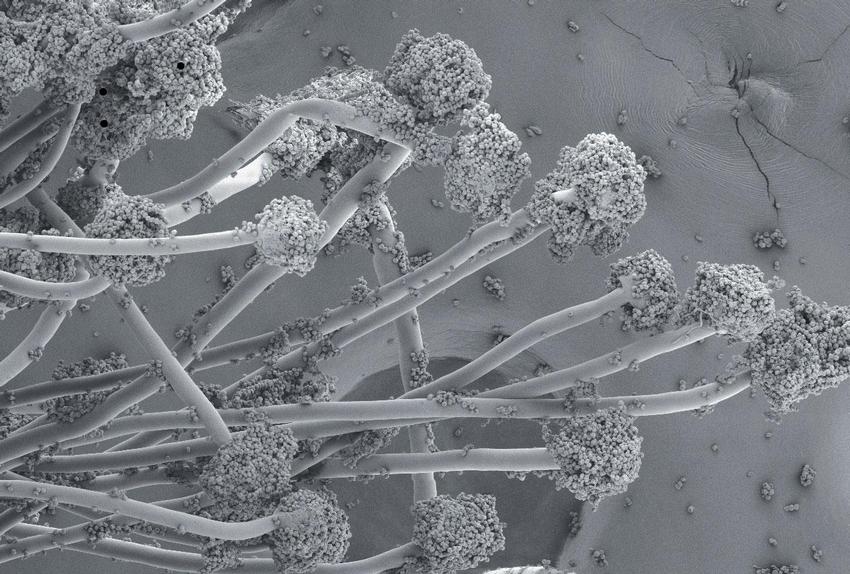
Aspergilóza se vyskytovala u pacientů po alogenních HSCT v 6,3 %, po autologních HSCT v 0,4 %.(18) Ze zygomycet se v našich klimatických podmínkách vyskytují pouze zástupci řádu Mucorales (Mucor spp., Rhizopus spp., Rhizomucor spp., Absidia corymbifera), z rodu Fusarium je nejčastěji izolováno Fusarium solani (Obr. 6) a F. oxysporum. Plíce jsou pak orgánem, ve kterém se onemocnění vyvolaná vláknitými houbami klinicky manifestuje nejčastěji. V italské multicentrické studii z hematologických pracovišť byly plíce při IFD postiženy v 85 % případů aspergilovou infekcí a v 64 % při infekci vyvolané zygomycetami.(19) Koincidence houbových infekcí navzájem nebo s cytomegalovirovou či bakteriální pneumonií je běžně popisována a je spojována se zhoršenou prognózou onemocnění.
Jak již bylo řečeno, většina vláknitých hub jsou ubikvitární saprofyté, jejich výskyt souvisí s endemickými klimatickými podmínkami. Spory se volně pohybují vzduchem a ulpívají na předmětech či potravinách. Mohou pak kontaminovat vzorky jak při odběru, tak při zpracování v laboratoři. Dýchací cesty mohou být kolonizovány sporami vláknitých hub, a to i u zdravých jedinců. Ve studii z 23 velkých nemocnic v USA a z 1 v Kanadě byla sledována kolonizace pacientů aspergily. V souboru 1209 kolonizovaných pacientů byli nejčastěji zastoupeni pacienti s plicním onemocněním (40 %), léčení kortikoidy (32 %) a diabetici (12 %). Pacienti s hematologickými malignitami byli kolonizováni v 9 %, pacienti po alogenních HSCT ve 3 %, po autologních HSCT v 1 %.(20) Zvýšený výskyt aspergilózy je spojován se stavebními pracemi a zvýšeným obsahem spor v ovzduší, spory hub byly opakovaně prokázány v nemocniční klimatizaci, vodovodním systému i potravinách.(21, 22) Onemocnění může být tedy způsobeno aktivací endogenního zdroje kvůli snížené obranyschopnosti organismu nebo se může jednat samozřejmě i o nozokomiální exogenní infekci získanou z již zmíněných zdrojů.
Při interpretaci kultivačního nálezu mikromycet v BAT je vždy nutné posuzovat výsledek v závislosti na klinickém obrazu, predispozičních faktorech hostitele a celkovém mikrobiologickém nálezu včetně mikroskopického obrazu. Invazivita procesu je jednoznačně prokazatelná pouze histologicky. Kvantifikace kultivačního nálezu není pro stanovení diagnózy podstatná.
Průkaz houbových antigenů z BAT
Průkaz houbových antigenů z BAT je možné využít při diagnostice aspergilózy a kryptokokózy. Galaktomanan (GM) je teplotně stabilní polysacharid buněčné stěny aspergilů, který je uvolňován během stavby buněčné stěny houby do jejího okolí. Kromě aspergilů mohou GM uvolňovat i jiné druhy hub, hlavně Penicillium spp., ostatní mikromycety většinou však v nedetekovatelném množství. diagnostiku GM se využívá monoklonální krysí protilátka, která rozpozná imunoreaktivní galaktofuranosylové řetězce v molekule polysacharidu, a to buď metodou latexové aglutinace (Pastorex Aspergillus, Bio-Rad, Francie), nebo ELISA (Platelia Aspergillus, Bio-Rad, Francie). Obě tyto metody byly vyvinuty pro detekci GM v séru. Latexová aglutinace je metoda kvalitativní, s detekčním limitem 15 ng antigenu v 1 ml. Pro nízkou senzitivitu ustupuje značně do pozadí a je nahrazována metodou ELISA, jejíž detekční limit je menší než 1 ng/ml. Výsledek je udáván jako tzv. index pozitivity (IP) nebo v zahraniční literatuře jako galactomanan index (GMI), což je poměr optické denzity vyšetřovaného vzorku a kontrolního cut off vzorku. Jako pozitivní je uznán vzorek s IP ? 0,5. Vždy vyžadujeme konfirmaci pozitivity v dalším odběru.
Studie prokazují vysokou specificitu i senzitivitu testu v séru. Pfeiffer et al. udávají v metaanalýze zahrnující 27 studií specificitu 89 % a senzitivitu 71 %.(23) Senzitivita testu však souvisí úzce s antigenní náloží v místě detekce. In vitro na lidských alveolech byla prokázána závislost mezi produkcí galaktomananu a intenzitou růstu aspergilových hyf. Po 14 hodinách od inokulace Aspergillus spp. byly již zaznamenány zvyšující se hladiny GM.(24) Na zvířecích modelech pak bylo prokázáno, že rozvoj houbové infekce a její invazivita souvisí úzce se stupněm obranyschopnosti hostitele. Na králících, u nichž byla nastolena chemoterapií vyvolaná neutropenie, byl zaznamenán invazívní růst houby s postižením cév a vysokou hladinou GM, na rozdíl od králíků, jejichž imunosuprese byla nastavena kortikoidy. Zde byla zaznamenána podstatně nižší intenzita růstu houby, téměř bez angioinvaze, a nízká hladina GM. I u pacientů se potvrzuje, že detekce GM v séru má nejvyšší diagnostický přínos u neutropenických pacientů s hematologickými malignitami, kde je úspěšně využívána i pro screening aspergilózy či jako monitoring léčby.(25, 26, 27) U non-neutropenických pacientů nebo pacientů s lokalizovaným aspergilomem nemusí být GM v séru vůbec detekován.(28) Souprava je standardizována pro sérum, následně však byla prokázána i možnost detekce z moče, moku, BAT i tkáně.(29) Úvaha, že v BAT získané z infikované lokality může být GM zachycen dříve a ve větší intenzitě než v séru, je ve světle výše zmíněných poznatků logická.
Tab. charakterizuje studie zabývající se detekcí GM z BAT u pacientů neutropenických, s hematologickými malignitami, po HSCT a solidních orgánových transplantacích (SOT). Z uvedeného je patrné, že detekce z BAT má vyšší senzitivitu i specificitu než detekce ze séra. Bohužel poměrně nízká pozitivní prediktivní hodnota (PPV) ukazuje na časté falešné pozitivity. Ve většině případů se autoři pokusili korigovat tento nepříznivý jev zvýšením cut off hodnoty indexu pozitivity. Ukazuje se, že nejpřínosnější poměr mezi senzitivitou testu a specificitou je zachován při cut off IP ? 1,0.
Zásadní je práce Maertense at al., kteří analyzovali 99 BAT od pacientů s hematologickými malignitami, z nichž 58 mělo prokázanou nebo pravděpodobnou invazívní plicní aspergilózu (IPA) a 44 tvořilo kontrolní skupinu. BAT vyšetřili mikroskopicky, kultivačně a na průkaz GM ELISA metodou. Vyhodnotili senzitivitu, specificitu, negativní (NPV) a pozitivní prediktivní hodnotu při různých cut off hodnotách IP (? 0,5, ? 1,0, ? 1,5, ? 2,0) v souboru prokázaných IPA a prokázaných a pravděpodobných IPA. Jako optimální hodnotu při detekci GM z BAT doporučili IP ? 1,0, kdy senzitivita byla 91,3 %, specificita 87,7 %, NPV 96 %, PPV 76,3 % v souboru prokázaných a pravděpodobných IPA. Zásadní rozdíl byl hlavně v parametru PPV, která při cut off hodnotě IP ? 0,5, byla pouhých 68 %. V souboru prokázaných IPA byla shodná specificita, vyšší senzitivita (96,7 %), vyšší NPV i PPV (98,4 % a 77,3 %). Senzitivita vyšetření při použití kultivace, mikroskopie a ELISA detekce GM z BAT při IP ? 1,0 byla 98,2 %.(33) Meersseman et al. sledovali přínos detekce GM v BAT u pacientů na multioborové JIP.
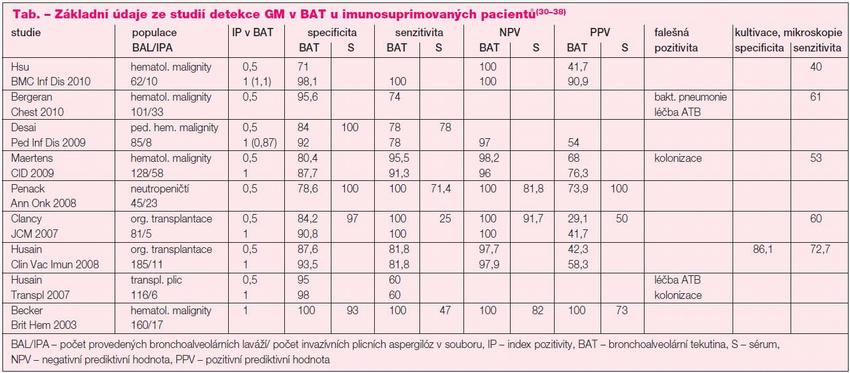
Vyšetřili mikroskopicky, kultivačně a na přítomnost GM ELISA metodou (cut off IP ? 0,5) 159 BAT u 110 pacientů, z nichž 26 mělo prokázanou IPA, 8 pravděpodobnou a 27 možnou, zbytek tvořil kontrolní skupinu. GM byl pozitivní u všech pacientů s prokázanou IPA, ovšem u třech až při druhé BAT. 14 pacientů mělo zároveň negativní GM v séru. Z kontrolní skupiny byl GM v BAL pozitivní u 3 pacientů, následně se však u nich prokázala kolonizace dýchacích cest. Senzitivita detekce GM v BAL byla 87 %, specificita 88 %, senzitivita v séru 42 %. Senzitivita kultivace a mikroskopie byla 58 %. Autoři hodnotili metodu detekce GM v BAT jako přínosnou pro diagnostiku aspergilózy na JIP.(39) U pacientů bez deficitu imunity s chronickou plicní aspergilózou či aspergilomem má vyšetření GM v BAT vysokou senzitivitu, avšak nízkou PPV vzhledem k poměrně vysokému počtu falešně pozitivních výsledků.(40) U těchto pacientů je proto doporučeno hodnotit výsledek obezřetně, vždy v souvislosti s klinikou a ostatními výsledky včetně detekce aspergilových protilátek.
Falešná pozitivita je nalézána při kolonizaci dýchacích cest vláknitými houbami, podávání antibiotik a při použití roztoku Plasma-Lyte pro provádění BAL.(31, 33, 37,41) Husain et al. hodnotili detekci GM z BAT u pacientů po transplantaci plic, kde bývají dýchací cesty často kolonizovány vláknitými houbami. Otestovali 333 BAT od 199 pacientů, jistá a pravděpodobná IPA se vyskytla v 5,8 % případů. Senzitivita a specificita při cut off IP ? 0,5 byla 60 % a 95 %, při IP ? 1,0 60 % a 98 %. Autoři se zaměřili hlavně na příčiny falešné pozitivity a zjistili, že v 9 případech byla způsobena kolonizací dýchacích cest plísněmi z rodu Aspergillus, Penicillium nebo Paecilomyces, v 1 případě podáním piperacillin-tazobaktamu. Ve 3 případech se příčinu nepodařilo zjistit, IP se ale pohyboval vždy pod hodnotou 1,0.(37) Autoři, v souladu s dalšími, upozorňují na diametrálně nižší hodnoty IP naměřené u kolonizovaných pacientů než u pacientů s IPA.(37, 39) Falešná negativita bývá spojována s podáváním antimykotické terapie.(37, 39) Metaanalýza 13 studií detekce GM v BAT u imunosuprimovaných pacientů prokázala senzitivitu vyšetření 90 %, specificitu 94 % a pravděpodobnost, že rizikový pacient má invazívní aspergilózu při pozitivním výsledku 67 %, při negativním 1 %.(42) Na základě těchto poznatků bylo ECIL (International Immunocompromised Host Society) doporučeno posuzovat GM v BAT u neutropenických i non-neutropenických pacientů jako pozitivní při hodnotách IP ? 1,0 (síla doporučení BIII). Při hodnocení je třeba vzít v úvahu možnost falešné pozitivity zvláště při kolonizaci dýchacích cest vláknitými houbami a event. falešnou negativitu při léčbě antimykotiky.
Pro diagnostiku invazívních kryptokokových infekcí se používá stanovení antigenu kryptokoků glukuronoxylomananu metodou latexové aglutinace (Pastorex Crypto Plus, BioRad, Francie). Souprava je standardizována pro detekci antigenu v séru, moku, moči i bronchoalveolární tekutině.
Závěr
BAT má v mykologické diagnostice nezastupitelné místo, vzhledem k tomu, že převážná většina infekcí vyvolaných vláknitými mikromycetami postihuje právě plíce. Kultivace a mikroskopie jsou základními vyšetřovacími metodami. Vzhledem k jejich nižší senzitivitě je vhodné doplnit spektrum metod o průkaz komponent buněčné stěny hub a při hodnocení testu na průkaz galaktomannanu metodou ELISA v BAT respektovat doporučenou hraniční hodnotu IP ? 1. Do budoucna jistě nezastupitelnou roli budou hrát i metody molekulárněgenetické. Základem úspěchu je vyšetřovat dostatečně validní klinický materiál a nález interpretovat s přihlédnutím ke klinice, predispozici pacienta a všem dalším faktorům, které mohou výsledek ovlivnit.
O autorovi: MUDr. Naďa Mallátová
Nemocnice České Budějovice, a. s., Centrální laboratoře, Laboratoř lékařské parazitologie a mykologie
e-mail: mallatova@nemcb.cz

