Summary
Mallátová, N., Hamal, P., Kocmanová, I., Buchta, V., Mencl, K. Testing of micromycets' susceptibility to antifungals in vitro in immunosuppressed patients – expert recommendations with the support of CELL and SLM CLS JEP
A significant increase in the frequency of systemic fungal infections in patients with serious diseases was observed in the last twenty years. Thus a number of new antifungal agents were developed, but micromycets' resistance was also gradually growing in the population. Based on the need for an early and objective detection of this resistance the importance of determination of susceptibility to antifungal agents in vitro, including the need for unification of methodologies, was increasing. In this article the development and basic features of current standardized procedures are summarized and the significance of derived commercial products for diagnostic practice is assessed. In further parts of the article current approaches to the interpretation of results are discussed and the importance of clinical breakpoints is commented. The circumstances under which it is advisable to perform susceptibility testing are mentioned and knowledge, limiting our options in terms of properties of individual groups of antifungals and micromycets' species, is listed. In conclusion, recommendations for the use of methods for detecting resistance of yeasts and filamentous fungi in isolates obtained from immunocompromised patients, through summarization of the most important concepts, are developed.
Stanovení citlivosti mikroskopických hub k antimykotikům in vitro slouží k detekci rezistentních kmenů v populaci mikromycet nebo k odhalení rozvíjející se rezistence během terapie. Až do počátku 90. let byl význam této části mykologické diagnostiky podružný, neboť bylo k dispozici jen velmi omezené spektrum systémových antifungálních látek s dominantní rolí amfotericinu B. Potřeba nových léků vyvstala s nárůstem frekvence systémových mykóz v posledních dvaceti letech, což bylo způsobeno hlavně rozvojem terapeutických postupů u pacientů se závažnými onemocněními, zejména hematologickými malignitami, solidními tumory, transplantacemi krvetvorných i solidních orgánů, AIDS apod., jejichž důsledkem jsou těžké imunodeficitní stavy a predispozice k mykotickým infekcím. Tento proces s sebou přináší nejen potřebu nových léků, ale – jako důsledek jejich užívání – i nárůst rezistencí v populaci mikromycet. S nástupem nových generací antifungálních látek došlo i k rozvoji a standardizaci metodik pro testování citlivosti kvasinek a později i vláknitých hub.
Cílem tohoto článku je seznámit čtenáře se standardními technikami i komerčními soupravami pro testování citlivosti lékařsky významných hub k antimykotikům a doporučit vhodné postupy, které by zajistily dostatečnou reprodukovatelnost získaných výsledků a přispěly k úspěšné léčbě mykóz u imunosuprimovaných pacientů.
Standardizované postupy
Historický přehled
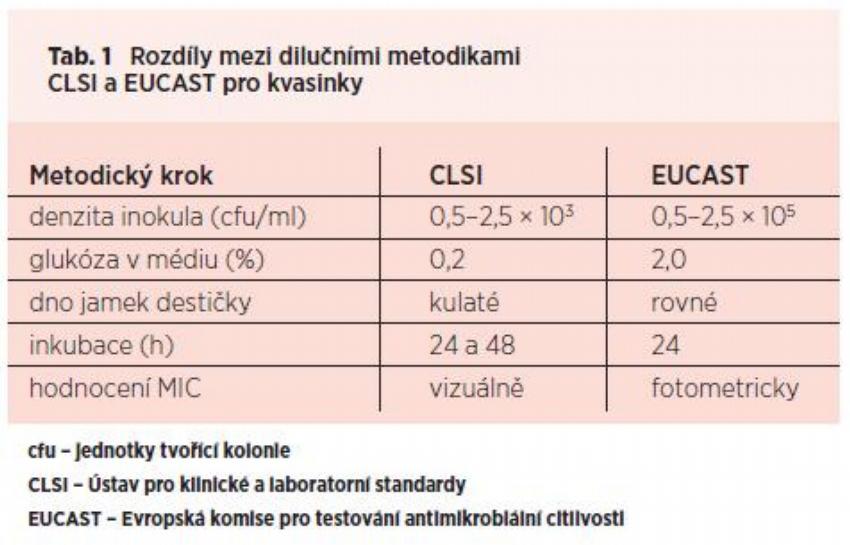
Vývoj standardních metodik pro testování citlivosti mikromycet k antimykotikům po dlouhou dobu zaostával za rozvojem postupů ke sledování rezistence baktérií k antibiotikům. Je to pochopitelné vzhledem k poměru frekvencí výskytu bakteriálních a mykotických infekcí, navíc dříve jen velmi omezené spektrum antifungálních látek nahrávalo empirické strategii léčby. Dlouho chyběla jakákoli šířeji akceptovaná metodika testování, kromě toho byla multicentrickými studiemi často zjišťována neakceptovatelně nízká míra shody hodnot minimálních inhibičních koncentrací (MIC) v jednotlivých laboratořích při porovnávání výsledků testování stejných kmenů. Mezníkem na cestě k přípravě první standardní metodiky byl rok 1982, kdy byla v rámci tehdejšího amerického Národního výboru pro klinické laboratorní standardy (NCCLS, nynějšího Ústavu pro klinické a laboratorní standardy – CLSI) ustanovena subkomise pro testování citlivosti k antimykotikům. Prvním výsledkem její práce byl dokument M27, popisující diluční bujónovou metodu pro testování citlivosti kvasinek, jejíž první (navrhovaná = proposed) verze byla zveřejněna v roce 1992.(1)
Od té doby vznikly celkem 3 další dokumenty, M38 pro testování vláknitých hub diluční metodou, M44 a M51 pro stanovení kvasinek, resp. hyfomycet (s výjimkou dermatofyt) difúzní diskovou metodou.(2–4) V Evropě byla v roce 1997 založena Evropská komise pro testování antimikrobiální citlivosti (EUCAST), v rámci níž vznikla subkomise pro testování antifungální citlivosti (AFST). Ta je autorem zatím dvou dokumentů, E. Def.7.1 a E. Def.9.1, popisující diluční metodiky testování citlivosti fermentujících kvasinek, resp. konidioformních vláknitých hub k systémovým antimykotikům.(5, 6) Americký a evropský postup provádění dilučních metod se principiálně shodují, nicméně v některých aspektech, sumarizovaných pro kvasinky v Tab. 1, se liší. Mimo zmíněné standardy EUCAST má v Evropě samostatný oficiální dokument Německo, týká se mikrodiluční metody a má charakter normy; konkrétně se jedná o DIN 58940-84 z roku 2002.(7) Všechny uvedené dokumenty postupně prošly procesem připomínkování, do současné doby bylo u většiny z nich zveřejněno již několik verzí a nyní mají vesměs podobu schválených (angl. approved), resp. definitivních metodických postupů. Kvantitativní mikrodiluční metoda je v současné době standardizována pro amfotericin B, flucytosin, ketokonazol, flukonazol, itrakonazol, vorikonazol, posakonazol a echinokandiny, kvalitativní diskový difúzní test pro flukonazol, vorikonazol, posakonazol a kaspofungin. Vývoj dokumentů NCCLS/CLSI a EUCAST o testování antifungální citlivosti je sumarizován v Tab. 2.

Žádná ze standardních metodik zatím není dostatečně validována pro dimorfní houby. Mimoto difúzní metodu CLSI pro vláknité mikromycety nelze použít pro testování dermatofyt a kvantitativní metodu EUCAST pro jiné než fermentující kvasinky (např. kryptokoky). Metodické aspekty dilučních metod Při testování kvasinek podle metodiky M27 CLSI je jako referenční metoda uvedena tzv. makrodiluční procedura, prováděná v běžných zkumavkách (12 x 75 mm), postup využívající mikrotitrační destičky (tzv. mikrodiluce) je považován za odvozenou a adekvátní modifikaci. Zcela naopak je tomu v případě vláknitých hub v dokumentu M38. Oba evropské standardy popisují pouze mikrodiluční postupy.
Prvním (a snad největším) problémem při zavádění těchto metodik do běžné diagnostické praxe je omezená dostupnost originálních antimykotických substancí. Je totiž nutné získat jejich čisté formy přímo od výrobců, případně ze spolehlivých komerčních zdrojů. Přípravky pro klinické použití by rozhodně neměly být používány. První uvedená varianta získání je sice zdarma, bývá však administrativně poněkud náročná. Komerčně je u některých firem specializovaných na chemikálie (např. Sigma Aldrich) dostupný omezený počet substancí antimykotik, většinou však pouze těch vývojově starších.
Aby byla zachována účinnost antimykotika, je třeba substanci odpovídajícím způsobem skladovat, tj. v desikátoru, nejlépe vakuu, obvykle při -20 °C a méně. Kromě generického názvu, čísla šarže a data expirace substance je třeba znát i její aktivitu, tj. množství účinné látky (v µg nebo mezinárodních jednotkách) v 1 mg substance. Zmíněný údaj je důležitý pro výpočet hmotnosti antimykotika, nutné pro přípravu standardního roztoku. Vehikulem je voda (flucytosin, flukonazol, kaspofungin, mikafungin) nebo dimetylsulfoxid (amfotericin B, ketokonazol, itrakonazol, vorikonazol, posakonazol, anidulafungin). Připravené zásobní roztoky je možné uchovávat při teplotě -60 °C nebo nižší po dobu nejméně 6 měsíců bez signifikantní ztráty aktivity. Jako půda je doporučováno syntetické médium RPMI 1640 s glutaminem, bez bikarbonátů a s fenolovou červení jako indikátorem pH. Dokumenty CLSI a EUCAST se liší množstvím glukózy v tomto bujónu, první uvádí 0,2 %, druhý doporučuje 2 %. Kyselost půdy je nutné nastavit na 7,0 ± 0,1 při 25 °C a udržovat ji na této hodnotě, nejlépe pufrem z 3-(N-morfolino)propansulfonové kyseliny (MOPS). Metodika CLSI M27 zmiňuje i alternativy k RPMI 1640: pro zlepšení průkazu rezistence kandid k amfotericinu B použití Antibiotic Medium 3 s vyhodnocením po 24 h a pro testování Yeast Nitrogen Base. Pro stanovení MIC itrakonazolu u vláknitých hub lze použít kolorimetrické stanovení s modifikovaným resazurinem jako indikátorem růstu.
Ke kultivaci izolátů je doporučen Sabouraudův dextrózový agar (SGA) či bramborový agar s dextrózou (PDA), pro indukci sporulace dermatofyt agar z ovesné mouky. Denzitu inokula je nejvhodnější upravit pomocí spektrofotometru při vlnové délce 530 nm, avšak pro vláknité houby preferuje metodika EUCAST stanovení množství konidií v počítací komůrce, což analogický dokument CLSI M38 uvádí jen v případě dermatofyt. Inkubace se obvykle provádí při 35 °C, její délka se však liší. Pro kvasinky uvádí evropský standard 24 h, který může být u Candida parapsilosis a Candida guilliermondii prodloužen o 12–24 h. V dokumentu M27 CLSI je 24hodinová inkubace doporučena především pro echinokandiny, neboť po 48 h dochází u této skupiny antimykotik k prudkému vzestupu MIC v důsledku vzniku fenoménu vleklého růstu (trailing). Dále je akceptována pro amfotericin B a flukonazol, u ostatních preparátů je preferován 48hodinový interval, i když recentní práce prokazují i u nich vysokou míru shody mezi MIC po 24 a 48 h.(8) U vláknitých hub je v evropské metodice uvedeno rozmezí 24–48 h, americká doporučuje nejkratší inkubaci u zygomycet (21–26 h), nejdelší naopak u scedosporií (70–74 h) a dermatofyt (4 dny). Růst v jamkách by měl být hodnocen vizuálně, pouze v dokumentu E. Def.7.1. pro kvasinky je preferována spektrofotometrie při 530 nm.
Důležitá je důkladná homogenizace média pomocí třepání před vlastním měřením. Proti kontrolní jamce bez antimykotika se odhaduje procento redukce růstu (zákalu) nebo se používá škálování: 0 – opticky čirá, 1 – mírně zkalená, 2 – výrazná redukce zákalu, 3 – mírná redukce zákalu, 4 – žádná redukce zákalu. V případě hodnocení citlivosti vláknitých hub k echinokandinům je navíc zavedena tzv. minimální efektivní koncentrace (MEC), definovaná jako jamka s nejnižší koncentrací antimykotika, v níž dochází k abnormálnímu růstu v podobě drobných okrouhlých mikrokolonií z krátkých větvených hyf v porovnání se splývavým růstem tvořeným dlouhými nevětvenými vlákny v kontrolní jamce.
Interpretace výsledků bude diskutována v dalších částech článku. Důležitou součástí metodiky je i kontrola kvality pomocí referenčních kmenů. Jsou dostupné v lyofilizovaném stavu v renomovaných sbírkách kultur hub, nejlépe v Americké sbírce typových kultur (ATCC). Jejich celkový přehled je uveden v Tab. 3. Identickými typovými kulturami disponuje i Česká sbírka mikroorganismů. Aby nedošlo ke změnám v jejich genomu, je třeba je dlouhodobě skladovat v hlubokomrazicím boxu při -70 °C, v 15% glycerolu. Po vyočkování kultury, nejlépe na SGA či PDA, je možné ji uchovávat v chladničce, jsou však povoleny maximálně tři pasáže ve dvoutýdenních intervalech, poté je nutné provést nové vyočkování ze zamražené kultury. Celkově lze shrnout, že diluční metody by svým kvantitativním charakterem byly vhodnou součástí rutinní diagnostiky systémových mykóz. Jejich nevýhodou, kromě obtížné dostupnosti substancí, je technicky poměrně náročné provedení. Řešením by mohla být centralizovaná výroba destiček s naředěnými antimykotiky, samozřejmě v případě podpory ze strany příslušných farmaceutických firem.

Standardizované difúzní metody
Disková difúzní metoda je jednoduchá, rychlá a finančně nenáročná. Technologie pro testování mikromycet je k dispozici v podobě dokumentů CLSI M44 pro kvasinky rodu Candida a M51 pro vláknité houby s výjimkou dermatofyt. Jejich hlavní charakteristiky a metodické rozdíly jsou sumarizovány v Tab. 4. Prvně zmíněný standard vychází ze studie ARTEMIS DISK Global Antifungal Surveillance (dále jen ARTEMIS), kde byla tato metoda testování navržená Meisem et al. a ověřena ve 142 laboratořích 41 zemí světa na přibližně 200 000 izolátech kvasinek.(9, 10) Základem je dodržet standardní metodiku, jejíž fáze jsou přehledně uvedeny v Tab. 4. Pro kultivaci je třeba použít Mueller-Hinton Agar (MHA – v případě kandid s přídavkem glukózy a metylénové modři) a zvolit disky s definovaným obsahem antimykotika, skladované podle pokynů výrobce. Inokulum u kandid se vytvoří z pěti náhodně vybraných kolonií, které jsou suspendovány ve fyziologickém roztoku, přičemž denzita je upravena na 1–5krát 106 cfu/ml. U vláknitých hub se suspendují spóry a po 3–5min sedimentaci se spektrofotometrem upraví denzita odebraného supernatantu tak, aby odpovídala 0,4–5krát 106 cfu/ml. Poté je v obou případech po 15 minutách provedena inokulace na testovací půdy pomocí vatového tampónu. Před aplikací disků je nutno vyčkat 3–5 min. Média jsou inkubována při 35 °C 24–72 h podle druhu testované mikromycety (viz Tab. 4).

Zóny inhibice růstu jsou hodnoceny posuvným měřítkem a evidovány. K hodnocení je možné využít i automatizované systémy (např. ADAGIO[BioRad Laboratories], BIOMIC [Giles Scientific, USA]). Na základě průměru zóny lze zařadit testovaný izolát do kategorií citlivý, citlivý v závislosti na dávce, intermediární, rezistentní nebo necitlivý. Důležité je používání referenčních kmenů, které je třeba uchovávat podobně jako v případě dilučních postupů. Po vyočkování ze zamražených kultur je nutná nejméně dvojí subkultivace, než lze kmen použít. Je tedy možno shrnout, že se jedná o technologicky podstatně jednodušší postupy v porovnání s dilučními metodami, zejména proto, že odpadá obstarávání a manipulace se substancemi Navíc jsou z velké části snadno „komercionalizovatelné“ (půdy, disky) a proto, na rozdíl od dilučních, vhodné pro použití v běžné laboratorní diagnostice, kde je lze využívat jako screeningové. Nevýhodou je pouze jejich kvalitativní charakter, proto by rezistence a snížené citlivosti, zjištěné uvedenými postupy, měly být ověřeny stanovením MIC.
Komerční soupravy
Kvalitativní metody
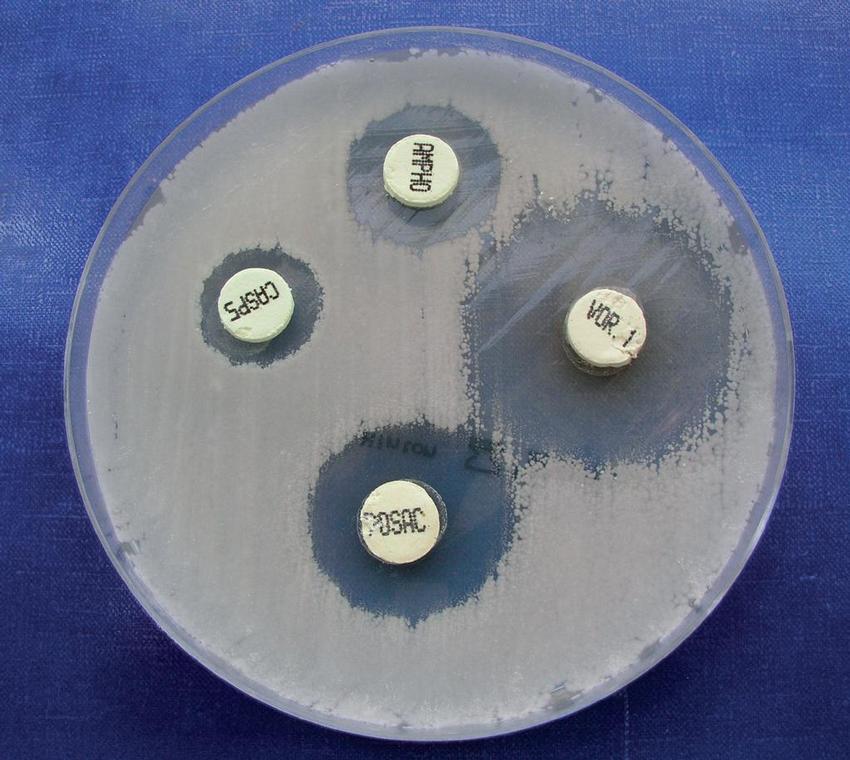
Neo-Sensitabs systém (Rosco Diagnostica, Dánsko) je variantou diskové difúzní metody, kdy místo disků jsou používány tablety se standardizovaným obsahem antimykotik (Obr. 1). Ze systémových jsou k dispozici amfotericin B, flucytosin, flukonazol, ketokonazol, itrakonazol, posakonazol, vorikonazol a kaspofungin. Firma má vypracované postupy, interpretační kritéria a systém kontroly kvality pro rozdílná testovací média (MHA se suplementem, RPMI 1640 s 2% glukózou a Shadomy agar). Metoda je celosvětově respektována a doporučována pro kvalitativní testování citlivosti k antimykotikům u kvasinek i vláknitých mikromycet.(11) Espinel-Ingroff et al. prokázali u kandid její vysokou shodu se standardní mikrodiluční technikou CLSI M27-A při použití MHA se suplementem u flukonazolu (95,5 %), vorikonazolu (95,5 %), itrakonazolu (92,7 %), kaspofunginu (94,5 %) a amfotericinu B (98,2 %), přičemž celková kategorická shoda (tj. souhlasné zařazení do kategorie citlivý, citlivý v závislosti na dávce, intermediární nebo rezistentní) byla 98,2 %. K nesouladu došlo pouze ve dvou případech u amfotericinu B.(12) U vláknitých hub byla korelace mezi Neo-Sensitabs a dilučním standardem CLSI M38-A sledována na 183 izolátech. U vorikonazolu a kaspofunginu byla zjištěna shoda 90 % a 95 %, u itrakonazolu, posakonazolu a amfotericinu B 85 %, 84 % a 79 %.(13)
Kvantitativní metody
Respektované a obecně doporučované metody pro rutinní stanovení MIC antimykotik jsou Etest a Sensititre YeastOne.(11) Etest (bioMérieux, Francie, dříve AB Biodisk, Švédsko) vychází z principu diskové difúzní metody, avšak s možností stanovení MIC. Etest je inertní plastikový proužek, který na jedné straně obsahuje exponenciální gradient koncentrací stabilizované antimikrobní látky v suchém stavu. Na druhé straně proužku je kontinuální stupnice, obvykle odpovídající 15 ředěním testovaného přípravku. Na povrch agaru, naočkovaného inokulem testovaného mikroba, se přiloží Etest stranou, která obsahuje antimikrobní látku. Po inkubaci se vytvoří kolem proužku zóna inhibice růstu kapkovitého až elipsovitého tvaru. MIC se odečítá v místě, kde okraj zóny přetíná proužek (Obr. 2, 3). K dispozici jsou diagnostické stripy se všemi významnými systémovými antimykotiky, tj. flukonazolem, ketokonazolem, itrakonazolem, vorikonazolem, amfotericinem B, flucytosinem, posakonazolem, kaspofunginem, anidulafunginem i mikafunginem. Je možné testovat kvasinkovité mikroorganismy i vláknité houby. Metodika je standardizována, výrobce poskytuje přesný návod na přípravu vhodného média a inokula, uvádí dobu inkubace, způsob kontroly kvality a interpretaci výsledku.(14) Přitom jsou plně respektována kritéria CLSI. Důraz je kladen na použití vhodného média. Za optimální je považováno RPMI 1640, pro azolové deriváty je možné použít agar s kasitonem.


Na rozdíl od standardní difúzní metody pro kvasinky není výrobcem doporučován MHA se suplementem. V publikaci Lee et al. byla celková esenciální shoda (tj. rozdíl maximálně 2 ředění) pro vorikonazol a flukonazol mezi Etestem na MHA se suplementem a makrodilucí podle CLSI M27-A u 179 kmenů 72 %, pro Candida glabrata a Candida parapsilosis byla však jen 50, resp. 54 %.(15) Řada studií potvrzuje vysokou korelaci Etestu se standardy CLSI i EUCAST.(16, 17, 18, 19) Fleck et al. udávají u 512 izolátů kandid kategorickou procentuální shodu pro flukonazol, vorikonazol, flucytosin, amfotericin B a kaspofungin při hodnocení za 48 h 91,6–98,2 %, za 24 h 91,6–98,6 %.(20) Vysoká korelace byla zjištěna také u aspergilů, celková shoda pro vorikonazol a itrakonazol byla 97,6 %, resp. 95,8 %. Velice dobré výsledky byly zaznamenány i při testování nových antimykotik, v případě posakonazolu byla esenciální shoda mezi Etestem a mikrodilučními technikami CLSI při testování 2171 izolátů kandid 94 % a 146 izolátů vláknitých mikromycet 96–98 %, z toho aspergilů 99,3 %.(21, 22) Ve studii Pfallera et al. bylo 133 izolátů kandid vyšetřeno na přítomnost mutací genů FKS1 a/nebo FKS2, kódujících glukan syntézu, a tím odpovědných za rezistenci kandid k echinokandinům. Etest odhalil u kaspofunginu a mikafunginu všechny mutace, u anidulafunginu zůstaly 2 ze 7 nezjištěny. Tyto výsledky se navíc shodovaly s testováním standardními metodikami CLSI i EUCAST.(23) Také u vláknitých mikromycet a echinokandinů se Etest jeví jako jejich vhodná alternativa, ve studii Martose et al. byla shoda u anidulafunginu a mikafunginu pro aspergily i fusaria 100 %, u kaspofunginu pro fusaria 100 % a pro aspergily 82,4–100 %.(24) V současné době jsou k dispozici i analogické proužky MIC Test Strip italské firmy Liofilchem Diagnostici, tento výrobek však zatím nemá žádnou oporu v literatuře.
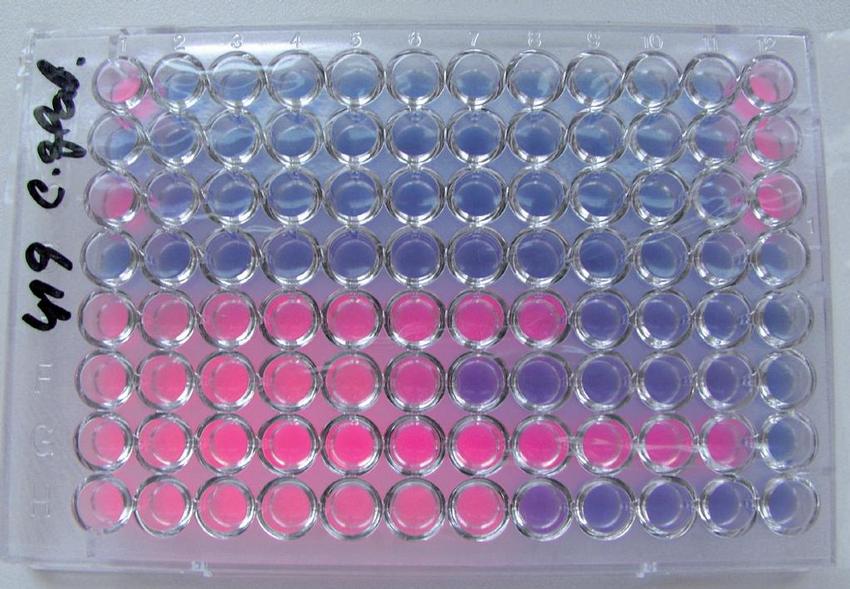
Sensititre YeastOne (TREK Diagnostic Systems, USA) je kolorimetrický mikrodiluční test. Jamky mikrotitrační destičky obsahují antimykotika v ředění odpovídajícím standardu CLSI M27-A 2 a kolorimetrický indikátor Alamar blue ve vysušeném stavu. Rehydratuje se suspenzí kvasinek (1,5krát 103 buněk/ ml) ve 100 µl RPMI média s 2% glukózou (lahvičky s půdou je možno objednat u výrobce). Doporučená inkubace při 35°C je 24 h pro kandidy, 72 h pro kryptokoky a 48–72 h pro aspergily. Růst mikromycet se projeví barevnou změnou v jamce (přechod z původní modré na růžovou). MIC se stanoví jako nejnižší koncentrace antimykotika se zachovaným modrým zbarvením (Obr. 4). Souprava se vyráběla v řadě variant, které obsahovaly různý počet antimykotik; všechna v současnosti dostupná systémová antimykotika jsou začleněna do nejnovější verze. Test je v literatuře hodnocen jako jednoduchý, spolehlivý a plně respektující standardní metodiku CLSI. Jeho velkou předností je jednoznačnost při odečtu výsledků a jejich mezilaboratorní reprodukovatelnost.
V práci Alexandera et al. byla na 212 izolátech kandid demonstrována celková esenciální shoda Sensititre YeastOne s metodikou M27-A2 pro amfotericin B ve výši 100 %, itrakonazol 96 %, flucytosin a kaspofungin 92 %, vorikonazol 85 % (ale u Candida tropicalis jen 76 %) a flukonazol 82 % (ale u C. glabrata pouze 66 %).(25) Pfaller et al. sledovali korelaci Sensititre YeastOne s CLSI pro echinokandiny na dvou kontrolních kmenech a dalších 404 izolátech kandid ve třech laboratořích. Esenciální shoda byla 100 % pro všechny echinokandiny, kategorická shoda 99,3 % pro anidulafungin a 100 % pro kaspofungin a mikafungin, mezilaboratorní shoda 99 %.(26) Metodou Sensititre YeastOne je navíc možné testovat citlivost kandid k antimykotikům přímo z hemokultivační nádobky. V souboru 40 kmenů kvasinek nedošlo při porovnání s hodnocením z narostlé kultury k žádné kategorické chybě.(27) Více autorů prokázalo možnost využití této techniky i při testování citlivosti aspergilů k amfotericinu B, vorikonazolu, itrakonazolu a posakonazolu.(28, 29, 30) K dispozici jsou i další podobné kolorimetrické mikrodiluční soupravy, jejich použití však nemá takovou oporu v literatuře jako Sensititre YeastOne. Jedná se zejména o panely Micronaut-AM (Merlin, Německo) a ASTY (Kyokuto Pharmaceutical Industrial Co., Japonsko). V ČR je distribuován pouze první z nich.
Z dalších souprav jsou v ČR k dispozici Fungitest a ATB Fungus.
Fungitest (Bio-Rad Laboratories, Francie) je souprava určená pro semikvantitativní stanovení citlivosti. Hodnocení se provádí pouze ve dvou jamkách, obsahujících hraniční koncentrace antimykotik, čímž je umožněno zařadit testovaný izolát do kategorií citlivý, citlivý v závislosti na dávce a rezistentní. Uvedeným způsobem je možno vyhodnotit citlivost kvasinek k celkem šesti antimykotikům (flukonazol, itrakonazol, amfotericin B, ketokonazol, mikonazol a flucytosin). V kontextu s recentně dostupnými možnostmi testování nelze soupravu doporučit ani pro screeningové vyšetřování citlivosti.
ATB Fungus (bioMérieux, Francie) jsou plastikové mikrodestičky s turbidimetrickým vyhodnocením. V současné době je k dispozici třetí generace (ATB Fungus 3). Umožňuje stanovení MIC u omezeného spektra systémových antimykotik: flukonazolu a vorikonazolu (po 8 ředěních), amfotericinu B a itrakonazolu (po 6 ředěních), flucytosinu (2 ředění). Echinokandiny ani posakonazol nejsou do soupravy zařazeny. Torres-Rodriguez et Alvarado-Ramirez udávají celkovou esenciální shodu mezi její dřívější verzí, ATB Fungus 2 (při automatickém odečítání) a standardní metodikou CLSI M27-A2 89–97 % pro itrakonazol, flukonazol, flucytosin a amfotericin B.(31) Esenciální shoda při porovnání této soupravy se Sensititre YeastOne byla 91,2–97,7 % pro amfotericin B, flucytosin a itrakonazol a 82,7 % pro flukonazol. Kategorická shoda byla u azolů pouze 72,9–75,9 %, u amfotericinu B 98,5 %.(32) Nevýhodou systému je nejednoznačnost vizuálního hodnocení (resp. potřeba turbidimetru) a omezené spektrum testovaných antimykotik.
Nově je v některých laboratořích zaváděn automatizovaný komerční spektrofotometrický systém VITEK 2 AST-YS (bioMérieux, Francie). Kromě biochemické identifikace kvasinek umožňuje stanovení MIC pro různé kombinace systémových V současné době nabízí firma na svém webu karty pro flukonazol a kombinaci kaspofungin, flukonazol a vorikonazol. Karty jsou minimalizovanou formou mikrodiluční metody, obsahují ovšem pouze vybraná ředění pro jednotlivá antimykotika. Výsledek je k dispozici během 9–27 hodin. Korelace se standardními technikami stanovení citlivosti CLSI i EUCAST je poměrně vysoká, problém nastává u pomalu rostoucích druhů. Cuenca-Estrella et al. porovnávali výsledky u 153 kmenů kvasinek. Udávají celkovou esenciální shodu mezi VITEK 2 a CLSI M27-A3 při hodnocení za 24 h 97,8 % a s EUCAST E. Def.7.1 97,9 %. Při sledování kategorické shody už výsledky nevypadají tak optimisticky, největší diskrepance byly u flukonazolu, kdy v osmi případech určil VITEK 2 jako rezistentní izolát, který byl standardem EUCAST vyhodnocen jako citlivý.(33) Při porovnání výsledků získaných systémem VITEK 2 a Sensititre YeastOne u 68 izolátů kandid z hemokultur byla pozorována esenciální shoda 78,4 %, 84,6 % a 90,8 % pro flukonazol, vorikonazol a amfotericin B. Při hodnocení kategorické shody opět vznikl problém s flukonazolem, kdy výsledky korelovaly jen v 76,9 %. U C. glabrata nebyla systémem VITEK 2 opakovaně stanovena MIC v důsledku insuficientního růstu v kontrolních jamkách.(34) Nevýhodou této metody je omezené spektrum antimykotik, omezený počet testovaných koncentrací a insuficientní růst některých druhů v tomto systému. Spíše pro experimentální účely jsou vhodné další metody, využívající např. redukčního potenciálu tetrazoliových solí, průtokové cytometrie, kvantifikace ergosterolu či spotřeby kyslíku.(35, 36, 37, 38) Na významu rovněž nabývá detekce rezistence pomocí molekulárněgenetických metod, zvláště k echinokandinům průkazem mutace genů FKS1 a/nebo FKS2.(39)
Kombinace antimykotik
In vitro testování vzájemné lékové interakce v případě kombinační terapie antimykotiky je v současné době spíše teoretickou možností, neboť není jednoznačná korelace s klinickou odpovědí, navíc výsledky získané jednotlivými postupy se ne zcela shodují. Nejčastěji je používána kvantitativní mikrodiluční metoda (Checkerboard microdilution system), výsledek je udáván jako FICI (fractional inhibitory concentration index). FICI se stanoví jako součet poměrů MIC antimykotik testovaných v kombinaci a samostatně. Synergismus, indiference a antagonismus jsou vyjádřeny hodnotami FICI ? 0,5; > 0,5 až ? 4,0; > 4,0. Další možností je sledování fungicidního efektu v čase (time-kill studies), kdy při synergní interakci dojde k poklesu infekční nálože o více než 2krát log cfu, při antagonismu naopak k vzestupu o stejnou hodnotu ve srovnání s nejúčinnějším lékem kombinace. Asi nejjednodušší metodou je Etest, kdy jsou nejprve testována jednotlivá antimykotika samostatně a pak jejich vzájemná interakce tak, že se na půdu položí proužek s prvním antimykotikem, po hodině se opatrně odstraní a do stejné pozice umístí proužek s druhým. Jako synergní je účinek hodnocen tehdy, dojde-li při porovnání výsledků k poklesu MIC u kombinace o více než 3 ředění, jako antagonistický naopak v případě jejího analogického vzestupu, jinak se jedná o aditivní efekt.(40, 41)
Interpretace výsledků
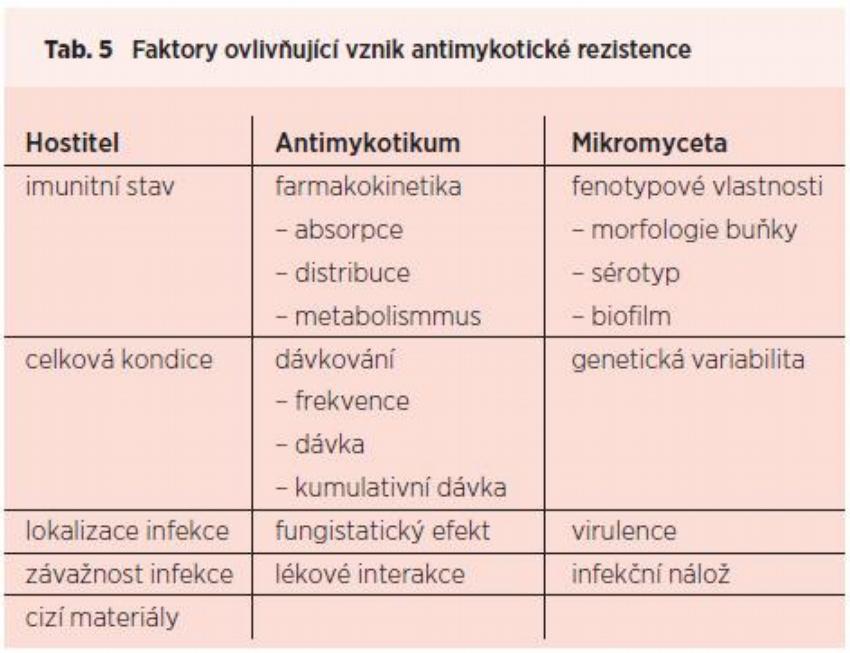
Vývoj testování citlivosti mikromycet k antimykotikům je spojen s rozšiřováním spektra antifungálních látek a datuje se zhruba do doby vstupu flukonazolu do praxe, což je přibližně 20 let. Přesto stále není možné poskytnout klinickému lékaři jednoznačnou odpověď, které antimykotikum použít a zda bude terapeuticky efektivní. Často je v této souvislosti citována práce Rexe et al., charakterizující úspěšnost léčby pravidlem „90 – 60“, což znamená, že infekce vyvolané in vitro citlivými kmeny reagují na léčbu v 90 % případů, zatímco infekce vyvolané in vitro rezistentními kmeny v 60 % případů.(42) Výsledný terapeutický efekt není určován jen vlastnostmi léčiva, ale i faktory na straně houbového mikroorganismu a jeho hostitele, které jsou sumarizovány v Tab. 5. Při práci s laboratorním výsledkem je proto třeba brát v úvahu všechny tyto vlivy.
Interpretační kritéria
Klinické MIC breakpointy (BP) jsou výsledkem sledování rozložení MIC v populaci mikroorganismů, farmakokinetických a farmakodynamických parametrů léčiva a klinických studií. Tyto BP byly zatím ustanoveny pouze pro kandidy v rámci standardů CLSI M27-A3 pro flukonazol, itrakonazol, vorikonazol, flucytosin, echinokandiny a M44-A2 pro flukonazol, vorikonazol, kaspofungin. EUCAST definovala původně klinický BP pouze pro flukonazol, vorikonazol a Candida albicans, C. parapsilosis, C. tropicalis. Aktuální hodnoty BP jsou přehledně shrnuty v Tab. 6. I když se metodiky CLSI a EUCAST liší v maličkostech, BP jsou rozdílné zásadně. Ve srovnávacích studiích však byla korelace mezi výsledky získanými technikou CLSI a EUCAST uspokojivá (85–95 %).(43, 44, 45) Rozvoj dalších znalostí, založených hlavně na objasnění vzniku rezistence u jednotlivých skupin antimykotik, její detekce pomocí genetických metod a na řadě epidemiologických a klinických studií přinesl změny, které vedly ve svém důsledku k přiblížení interpretačních kritérií CLSI a EUCAST. Významnou roli hraje stanovení epidemiologické cut-off hodnoty (ECV) antimykotik pro jednotlivé druhy kvasinek a vláknitých hub. ECV je matematicky stanovené číslo vycházející ze standardního rozložení MIC v populaci sledované mikromycety (Gaussova křivka) a nejlépe vystihující, kde v ní končí normální distribuce MIC. Při sledování rozložení MIC flukonazolu v populaci kandid byla zásadní práce Pfallera et al.
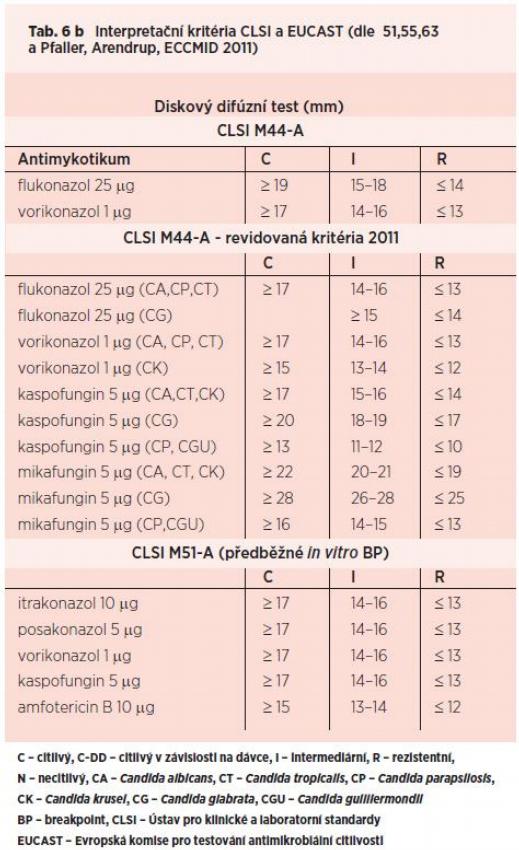
Byla v ní testována citlivost k flukonazolu u 15 020 izolátů kandid získaných ze studie ARTEMIS a sledována distribuce MIC v populaci sedmi nejčastěji se vyskytujících druhů. Následně byla stanovena ECV pro inkubaci 24 a 48 h. Pro C. albicans, C. parapsilosis a C. tropicalis byla ECV velice nízká (0,5 µg/ml, 2 µg/ml, 2 µg/ml, bez rozdílu při hodnocení za 24 a 48 h) ve srovnání s C. glabrata (32 µg/ml). Největší procento izolátů s MIC ? ECV bylo zjištěno u druhu C. parapsilosis (98,4 %), nejmenší u C. glabrata (91,4 %).(47) Výsledky se shodovaly s obdobnou studií EUCAST a potvrzovaly tak správnost determinace druhově specifických BP.(48) Korelace mezi terapeutickou úspěšností a hodnotou MIC byla prokázána opakovaně.(49, 50) Tyto a další studie, zabývající se molekulárně genetickou detekcí rezistence kandid k flukonazolu a dalším azolům, vedly subkomisi CLSI pro testování citlivosti k antimykotikům k vydání obsáhlé přehledové práce, ve které doporučuje harmonizovat standardizované metody CLSI a EUCAST, zejména pak jejich interpretační kritéria. Revidovaný BP CLSI pro flukonazol je druhově specifický. Jako citlivý k flukonazolu je v případě druhů C. albicans, C. tropicalis a C. parapsilosis označen izolát s hodnotou MIC ? 2 µg/ml. Kmeny C. glabrata jsou považovány za citlivé v závislosti na dávce, je-li MIC ? 32 µg/ml. Candida krusei je k flukonazolu primárně rezistentní.(51) Obdobný vývoj můžeme sledovat také u vorikonazolu. CLSI vydal BP pro rod Candida, což bylo opakovaně diskutováno. Např. Arendrup et al. konstatovali nevhodnost interpretace MIC 2 µg/ml jako citlivost závislou na dávce vzhledem k tomu, že případná úprava dávky vorikonazolu se odvíjí od dosažených sérových koncentrací antimykotika.(52) EUCAST doporučila na základě studií ECV a zjištěného významného rozdílu mezi hodnotami pro C. albicans, C. parapsilosis a C. tropicalis vs. C. glabrata a C. krusei stanovení druhově specifických BP.(53)
Pfaller et al. otestovali 16 191 izolátů kandid získaných ze studie ARTEMIS a potvrdili nízkou ECV vorikonazolu pro C. albicans (0,03 µg/ml; zahrnovala 99 % testovaných izolátů), C. parapsilosis (0,125 µg/ml; 97,8 %), C. tropicalis (0,06 µg/ml; 97,3 %) oproti vyšším u C. glabrata a C. krusei (oba druhy 0,5 µg/ml; 90,4 %, resp. 99,4 %).(54) Následně, spolu se subkomisí CLSI pro testování citlivosti k antimykotikům, navrhli revizi BP CLSI včetně zavedení druhově specifických BP. Podle ní jsou C. albicans, C. parapsilosis a C. tropicalis k vorikonazolu citlivá při MIC ? 0,125 µg/ ml a C. krusei při ? 0,5 µg/ml. Vzhledem k nedostatku dat prokazujících korelaci in vitro a in vivo nebyl ustanoven klinický BP pro C. glabrata.(55) Zároveň byla zavedena i ECV pro posakonazol a C. albicans (0,06 µg/ml; zahrnovala 98,4 % izolátů), C. parapsilosis (0,25 µg/ml; 99,3 %), C. tropicalis (0,12 µg/ml; 97,6 %), C. krusei (0,5 µg/ml; 99,0 %) a C. glabrata (2 µg/ml; 96,2 %) po inkubaci 24 h.(54) BP pro echinokandiny (2 µg/ml) byl CLSI stanoven na základě prací Pfallera et al., kteří testovali citlivost 5346 izolátů kandid ke všem echinokandinům. Více než 99 % z nich bylo inhibováno ? 2 µg/ml antimykotika.(56) Následně byly publikovány studie, které detekovaly genetickými metodami mutace na genech FKS1 a/nebo FKS2 a demonstrovaly, že MIC kmenů s prokázanou rezistencí je nižší než doporučené BP.(57, 58, 59, 60, 61) Provedené epidemiologické studie, sledující rozložení MIC echinokandinů v populaci kandid, ukázaly, že ECV pro C. albicans, C. tropicalis, C. krusei a C. glabrata je velice nízká pro kaspofungin a anidulafungin (0,12–0, 25 µg/ml) a ještě nižší pro mikafungin (0,03–0,12 µg/ml), přičemž zahrnuje 98,2–100 % testované populace. ECV pro C. parapsilosis a C. guilliermondii byla signifikantně vyšší, 1–16 µg/ml.(62)
Na základě zmíněných studií doporučila subkomise CLSI pro testování citlivosti k antimykotikům v letošním roce také pro echinokandiny definovat druhově specifické BP. C. albicans, C. tropicalis a C. krusei jsou citlivé ke kaspofunginu, anidulafunginu a mikafunginu při MIC ? 0,25 µg/ml, C. parapsilosis a C. guilliermondii při MIC ? 2 µg/ml, glabrata ke kaspofunginu a anidulafunginu při MIC ? 0,12 µg/ ml a mikafunginu při MIC ? 0,06 µg/ml.(63) Situace u vláknitých mikromycet je relativně složitější. Vzhledem k nedostatku studií prokazujících korelaci výsledků in vitro a in vivo není ustanoven žádný definitivní klinický BP pro vláknité houby. Je zřejmé, že výsledek léčby je u těchto mykóz podstatně více závislý na klinickém stavu hostitele. EUCAST stanovila předběžný BP pro Aspergillus fumigatus, izolát je považován za rezistentní při hodnotách MIC > 2 µg/ml u itrakonazolu a vorikonazolu a MIC > 0,5 µg/ml u posakonazolu. CLSI respektuje ECV, které byly stanoveny Pfallerem et al. pro A. fumigatus na souboru 637 izolátů a činí u itrakonazolu a vorikonazolu 1 µg/ml, u posakonazolu 0,25 µg/ml.(64) Uvedené hodnoty korelují s výsledky Rodriguez-Tudela et al.(65) Espinel-Ingroff et al. potvrdili na souboru přesahujícím 4000 izolátů aspergilů Pfallerovy ECV pro A. fumigatus a nově definovali ECV následujících antimykotik: itrakonazolu pro A. flavus, A. nidulans, A. terreus ve výši 1 µg/ml, A. niger, A. versicolor 2 µg/ml; vorikonazolu pro A. flavus, A. terreus 1 µg/ml, A. nidulans, A. niger, A. versicolor 2 µg/ml; posakonazolu pro A. flavus 0,25 µg/ml, A. terreus, A. niger 0,5 µg/ml, A. versicolor a A. nidulans 1 µg/ml.(66)
U echinokandinů je stanovována vzhledem k jejich fungistatickému působení MEC, kdy se jako hraniční koncentrace antimykotika hodnotí jamka s charakteristickou změnou růstu houby (viz část Metodické aspekty dilučních metod). Pfaller et al. testovali standardní metodikou CLSI M38-A2 citlivost 526 izolátů Aspergillus spp. k echinokandinům. MEC50 a MEC90 byly pro anidulafungin 0,007, resp. 0,015 µg/ml, kaspofungin 0,015/0,03 µg/ml a mikafungin 0,007/0,015 µg/ml. Více než 99 % izolátů bylo inhibováno < 0,06 µg/ml echinokandinu.(67) V jiné práci stanovili Pfaller et al. na souboru 1590 izolátů Aspergillus spp. ECV pro kaspofungin 0,06 µg/ml pro A. fumigatus, A. flavus, A. niger a A. terreus a 0,12 µg/ml pro A. versicolor.(68) Espinel-Ingroff et al. uvádějí na svém souboru 1691 izolátů Aspergillus spp. mírně odlišné hodnoty ECV pro kaspofungin: 95 % a 99 % testované populace nepřesáhlo hodnoty MEC (v µg/ml) v případě A. fumigatus ve výši 0,5, a 1, A. flavus 0,25/0,5, A. nidulans 0,5/0,5, A. niger 0,25/0,25, A. terreus 0,25/0,5 a A. versicolor 0,25/0,5.(69) BP není stanoven ani u amfotericinu B, jako respektovaná hodnota je udáváno MIC ? 1.(70) Z výše uvedených skutečností vyplývá, že v současné době neexistují jednoznačná interpretační kritéria při hodnocení výsledku testování in vitro citlivosti vláknitých hub k antimykotikům. Určitým vodítkem mohou být ECV. Laboratorní výsledky je tedy třeba hodnotit vždy s určitou rezervou a s přihlédnutím ke klinickému efektu léčiva.
Kontrola kvality
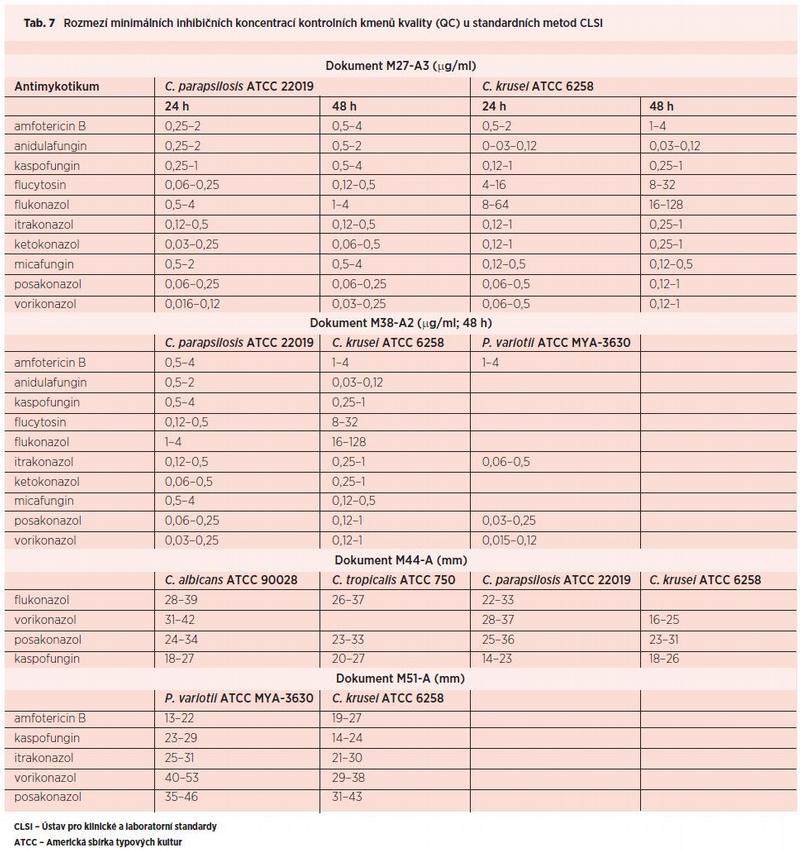
Dodržení doporučených postupů při použití standardních metodik stejně jako při práci s komerčními soupravami by mělo být naprostou samozřejmostí pro každou laboratoř, zabývající se testováním citlivosti mikromycet k antimykotikům. Pro kontrolu vlastních postupů slouží v obou případech kontrolní kmeny, u nichž jsou mezilaboratorními studiemi ověřeny hodnoty MIC, přehledně demonstrované v Tab. 7. Pomocí těchto kmenů lze kontrolovat metodiku pravidelně a navíc vždy při vstupu nových diagnostik do procesu (např. každou šarži půd a disků, Etestů, komerčních souprav). Je to jediná možnost, jak dosáhnout mezilaboratorní standardizace procesu a snížit pravděpodobnost laboratorní chyby, která ve svém důsledku může vést k zásadní chybě terapeutické.
Strategie testování
Testování citlivosti mikromycet k antimykotikům se provádí ze dvou důvodů, epidemiologických a terapeutických. V prvním případě je vhodné otestovat maximum houbové populace, vyskytující se ve sledovaném regionu. I když je obecná epidemiologická situace známa, mohou se v příslušné lokalitě objevovat ve zvýšeném procentu získané rezistence, např. v důsledku zvoleného druhu profylaxe, selekčního tlaku prostředí, kontaminace zdravotnických pomůcek, chyb v ošetřovatelské péči apod. Uvedené šíři testování však bude na většině pracovišť bránit finanční situace. Z klinického hlediska doporučují Rodriguez-Tudela et al. hodnotit citlivost izolátů získaných od pacientů s prokázanou a předpokládanou invazívní infekcí, na profylaxi a nereagujících na léčbu.(71) Lass-Flörl et al. navrhují testovat mikromycety izolované ze sterilních lokalit, u méně validních materiálů při opakované pozitivitě, od pacientů s invazívní mykózou, při selhání primární terapie, průlomových či rekurentních infekcích, dlouhodobé terapii azoly, dále u raritních druhů a případů zkřížených rezistencí.(70) Strategie testování konkrétního pracoviště jistě podléhá určitým lokálním zvyklostem, přesto je třeba zdůraznit, že u pacientů s hematoonkologickým onemocněním by měly být stanoveny MIC antimykotik minimálně u každého klinicky závažného izolátu, což nejsou jen kmeny z primárně sterilních lokalit, ale i např. vláknité mikromycety získané z dolních dýchacích cest. Rezistence zjištěné diskovým difúzním testem by měly být potvrzeny metodou umožňující definovat MIC minimálně v případě, že výsledek bude podkladem pro volbu antimykotika. Citlivost mikromycet k antimykotikům in vitro Mechanismy působení a rezistence jednotlivých skupin antimykotik jsou shrnuty v Tab. 8.

Kandidy jsou většinou in vitro dobře citlivé ke všem systémovým antimykotikům, včetně azolů, z běžně se vyskytujících druhů pouze C. krusei je primárně rezistentní k flukonazolu. K uvedeObr. antimykotiku mívá sníženou citlivost také další druh, C. glabrata. Má totiž velice nestabilní genom a k mutaci v genech, kódujících efluxní pumpy CgCDR1 a CgCDR2 a tím v hlavní míře odpovědných za rezistenci, může dojít i během jedné infekční epizody. Navíc se velice často jedná o zkříženou rezistenci mezi azolovými deriváty.(72) Asi největší epidemiologickou studií, hodnotící stav citlivosti lékařsky významných hub k antimykotikům, je již zmiňovaná ARTEMIS Pfallera et al., v rámci níž byla v průběhu deseti let vyšetřena standardní difúzní diskovou metodou citlivost 256 882 izolátů kandid k flukonazolu a 197 619 k vorikonazolu. Nejčastěji se vyskytující kvasinka, C. albicans (65,3 %), byla v 98 % citlivá k flukonazolu a v 98,5 % k vorikonazolu; C. glabrata (11,3 %) v 68,7 %, resp. 82,9 %; C. tropicalis (7,2 %) v 91 %, resp. 89,5 %; C. parapsilosis (6 %) v 93,2 %, resp. 97 %; C. krusei (2,4 %) byla citlivá k vorikonazolu v 83,2 %. Frekvence ostatních druhů byla do 1 %, u C. inconspicua, C. valida a C. lambica bylo však přes 50 % izolátů rezistentních k flukonazolu. Dále, kmeny některých druhů kandid rezistentní k tomuto antimykotiku byly z velké části odolné i vůči působení vorikonazolu, C. albicans v 63,6 %, C. glabrata v 59,2 %, C. tropicalis v 67,7 % a C. parapsilosis v 40,4 %. U C. krusei a C. inconspicua se však tento trend neprokázal (rezistence jen 9,2 %, resp. 6,1 %).
Celkově pouze 30 % kmenů rezistentních k flukonazolu zůstalo citlivých k vorikonazolu.(10) Pfaller et al. předpokládali, že citlivost kandid k vorikonazolu a flukonazolu může předpovídat citlivost také vůči posakonazolu. Testovali proto 10 807 izolátů, přičemž kategorická shoda při použití flukonazolu jako predikčního markeru byla 91,1 %, v případě vorikonazolu 97,7 %.(73) Výskyt zkřížené rezistence potvrzují i další autoři.(74, 75) V hematoonkologických a transplantačních centrech je zaznamenáván kromě změny epidemiologického spektra původců invazívní kandidózy i vyšší počet rezistentních druhů, hlavně C. glabrata, což bývá nejčastěji spojováno s podáváním flukonazolu nebo jiných azolů v profylaxi. V rámci zpracování údajů z databáze TRANSNET (Transplant-Associated Infection Surveillance Network), obsahující informace z 23 transplantačních center v USA, byla analyzována citlivost u celkem 383 klinických izolátů kandid, z toho bylo rezistentních k flukonazolu 16 %, vorikonazolu 3 % a itrakonazolu 17 %; přitom C. glabrata vykazovala rezistenci k flukonazolu ve 23 %, vorikonazolu v 8 % a itrakonazolu v 52 %. Pokud není definován BP, je možno stupeň citlivosti odvodit z MIC50 a MIC90 (tj. koncentrace antimykotika inhibující 50, resp. 90 % populace houby). Zmíněné hodnoty pro kandidy byly u posakonazolu 0,125, resp. 2 µg/ml, amfotericinu B 0,38, resp. 2 µg/ml a kaspofunginu 0,094, resp. 0,38 µg/ml.(76) V rámci studie ARTEMIS byla vyšetřena také citlivost 11 240 non-Candida kvasinek k flukonazolu a 8 717 k vorikonazolu. Cryptococcus neoformans byl k flukonazolu a vorikonazolu citlivý v 77,1, resp. 97 %, Saccharomyces cerevisiae v 89,9, resp. 95,8 %, Trichosporon asahii v 76,2, resp. 92,1 %, zatímco Rhodotorula spp. pouze ve 44,0 resp. 54,1 %.(77) Obecně je možno konstatovat, že v případě neúspěšné léčby některým z azolů není výměna za jiné antimykotikum z této skupiny vhodným řešením, zvláště v případech, nemáme-li k dispozici jeho aktuální hodnoty MIC.
Rezistence kvasinkových druhů k amfotericinu B či jeho lipidovým formám je popisována vzácně u C. krusei, C. glabrata a T. asahii, nejčastěji je však selhání této léčby spojováno s Candida lusitaniae.(78, 79) Mechanismus jejího získání není jednoznačně objasněn, navíc řada studií naopak dokládá u zmíněného druhu relativně vysokou citlivost in vitro k tomuto polyenu.(80, 75) Prigitano et al. testovali 107 klinických izolátů C. lusitaniae, přičemž se MIC amfotericinu B pohybovala v rozmezí 0,06–0,5 µg/ ml.(80) Přesto Pappas et al. v publikovaných doporučeních pro léčbu invazívní kandidózy preferují u infekcí vyvolaných C. lusitaniae zahájení léčby flukonazolem nebo echinokandinem vzhledem k pozorovanému klinickému selhání amfotericinu B.(81) Kandidy se zatím jeví jako vysoce citlivé ke všem echinokandinům, i když byly opakovaně popsány a genetickými analýzami následně potvrzeny klinické rezistence, především u C. albicans a C.glabrata. Navíc v této skupině antimykotik již byla dokumentována také zkřížená rezistence.(39, 82, 83) S avizovanou změnou BP je možno očekávat i zvýšené procento rezistencí in vitro. V poměrně rozsáhlé kanadské studii, jíž se účastnilo celkem 41 zdravotnických zařízení, byla testována citlivost u 5900 izolátů kandid k šesti antimykotikům včetně kaspofunginu a mikafunginu. Při použití stávajících BP bylo ke kaspofunginu rezistentních 0,2 % a k mikafunginu 0,15 % nejvíce se na tom podílela C. krusei (0,9 % k oběma echinokandinům). Pokud však byly výsledky interpretovány pomocí ECV, které se výrazně přibližují revidovaným BP, byla ke kaspofunginu rezistentní nejčastěji C. glabrata (9,2 %), k mikafunginu C. albicans (2,6 %).(75) V souvislosti s testováním citlivosti k echinokandinům bývá jako problematická označována C. parapsilosis. Vyšší hodnoty MIC, a tím i vyšší ECV jsou pravděpodobně způsobeny přirozeně se vyskytujícím polymorfismem na FKS1 genu.(84) Klinické studie však při léčbě infekcí vyvolaných C. parapsilosis echinokandiny demonstrují podobnou úspěšnost jako při použití jiných antimykotik.(85)
Přesto Pappas et al. doporučují při této etiologii zahájit terapii u hemodynamicky stabilních pacientů flukonazolem, u hemodynamicky nestabilních lipidovými deriváty amfotericinu B. Pokud však byla léčba echinokandinem zahájena před identifikací agens a je-li klinicky úspěšná, doporučuje se antimykotikum neměnit.(81) Zkřížená rezistence mezi echinokandiny a flukonazolem nebyla prokázána.(86) K této skupině antimykotik jsou však rezistentní kvasinky jiných rodů než Candida, konkrétně Trichosporon, Cryptococcus nebo Rhodotorula.(87) Z vláknitých hub je nejčastějším původcem invazívních mykóz A. fumigatus, který je in vitro relativně dobře citlivý k některým azolům, amfotericinu B i echinokandinům. Howard et al. analyzovali 13 studií s celkovým počtem přes 5000 izolátů A. fumigatus, které hodnotily citlivost k prvně zmíněné skupině antimykotik. Zjistili, že v průměru byly rezistentní 2 % (rozmezí 0–6 %) tohoto druhu.(88) Nizozemští autoři sledovali rezistenci k itrakonazolu u 2062 klinických izolátů A. fumigatus získaných v univerzitních nemocnicích v letech 2007–2009. Míra jejich rezistence byla 5,3 %, z toho bylo 79,8 % rezistentních i k vorikonazolu a 16,7 % k posakonazolu. Ze zmíněných izolátů A. fumigatus mělo 90,2 % prokázanou mutaci TR/L98H v genu CYP51. Mortalita pacientů infikovaných těmito kmeny byla 88 %.(89) Zmíněná mutace byla prokázána také u zástupců uvedeného druhu získaných z prostředí.
Fungicidní přípravky užívané v letech 1990–1996 nebyly na takové aspergily účinné, což pravděpodobně vedlo k selekci TR/L98H mutant.(90) Mutace byla prokázána i v okolních zemích, např. Dánsko uvádí frekvenci 8 %.(91) Rezistence k azolům byly popsány také u druhu A. calidoustus nebo u aspergilů ze sekce fumigati (A. lentulus, A. pseudofischeri, A. fumigatiaffinis).(92, 93) Problém může nastat u druhu A. lentulus, který je popisován jako rezistentní k amfotericinu B, přičemž je morfologicky neodlišitelný od A. fumigatus a k jeho identifikaci je proto nutno použít genetické metody. V souvislosti s rezistencí k amfotericinu B je často zmiňován A. terreus.(94, 95, 96) Inhalace amfotericinu B v aerosolu je udávána jako rizikový faktor pro infekci tímto druhem.(97) Steinbach uvádí vyšší úmrtnost pacientů léčených zmíněným polyenem při infekcích vyvolaných A. terreus (73,4 %) ve srovnání se skupinou, které byl podáván vorikonazol (55,8 %).(98) Naproti tomu analýzou údajů z databáze TRANSNET nebyl při léčbě amfotericinem B zjištěn rozdíl v mortalitě pacientů infikovaných A. fumigatus a A. terreus.
V rámci zmíněné studie byla potvrzena dobrá citlivost aspergilů k azolům, 95,9 % a 97,6 % izolátů mělo MIC vorikonazolu, resp. posakonazolu nižší než 4 µg/ml. Mezi rezistentními však byly všechny kmeny A. calidoustus.(76) Zkřížené rezistence azolů u rodu Aspergillus jsou opakovaně diskutovány. Existují práce, které dokládají jejich výskyt mezi itrakonazolem a posakonazolem, u pacienta na dlouhodobé profylaxi itrakonazolem byla popsána zkřížená rezistence mezi tímto antimykotikem a vorikonazolem.(99, 100) O rezistenci aspergilů k echinokandinům není zatím příliš informací, klinické rezistence ke kaspofunginu však již byly popsány.(101, 102) Zygomycety se vyznačují dobrou citlivostí in vitro k amfotericinu B a posakonazolu. Almyroudis et al. ve svém souboru 217 klinických izolátů uvádějí citlivost k amfotericinu B téměř jako 100% (při respektování hraniční hodnoty 1 µg/ml), jedinou výjimku představoval rod Cunninghamella, kde bylo 37 % kmenů rezistentních. Citlivost k posakonazolu (< 0,5 µg/ml) byla závislá na druhu a pohybovala se od 0 % (Mucor circinelloides) po 100 % (Absidia corymbifera).(103) U ostatních, vzácně se vyskytujících rodů vláknitých mikromycet (Scedosporium, Exophiala, Paecilomyces) není většinou možné predikovat situaci. Rovněž fusaria mohou být k amfotericinu B, vorikonazolu i posakonazolu in vitro citlivá, ale i rezistentní.(74) K echinokandinům jsou zygomycety, fusaria i další, zřídka se vyskytující vláknité houby zmíněné výše, rezistentní.
Závěr – doporučení odborníků
U imunosuprimovaných pacientů by měla být kvantitativně stanovena citlivost k antimykotikům při záchytu mikromycety z klinicky významných materiálů, u kolonizujících kmenů při opakované izolaci ve významné kvantitě nebo z více lokalit, neboť je velmi pravděpodobné, že tito pacienti budou léčeni. Pro kvantitativní stanovení připravili CLSI i EUCAST standardní metodiky, které však mají určitá omezení a navíc jsou pro běžné laboratoře technicky poměrně obtížně proveditelné. Z komerčně dostupných testů se jako nejvhodnější pro stanovení MIC u kandid a kryptokoků jeví Sensititre YeastOne, u vláknitých hub a dalších rodů kvasinek Etest. Difúzní disková metoda, prováděná podle standardu CLSI M44-A2, a Neo-Sensitabs systém jsou vhodné pro sccreeningové vyšetření, případně pro testování izolátů zachycených z klinicky méně závažných materiálů. Rezistence prokázané těmito metodami by měly být ověřené stanovením MIC minimálně v případech, kdy by tím bylo testované antimykotikum jako lék první volby vyloučeno z použití. Při interpretaci výsledku by měly být respektovány klinické BP, jsou-li k dispozici. Pokud nejsou stanoveny, je možné se orientovat podle ECV. Nelze zapomínat, že výsledný efekt léčby je vzájemnou interakcí mezi antifungálním preparátem, mikromycetou a hostitelem. citlivosti in vitro je tak pouze jedním z aspektů při výběru vhodného antimykotika.
Poděkování
Práce byla podpořena výzkumným záměrem MŠMT ČR č. MSM6198959223.
O autorovi: 1MUDr. Naďa Mallátová, 2doc. MUDr. Petr Hamal, CSc., 3Mgr. Iva Kocmanová, 4doc. RNDr. Vladimír Buchta, CSc., 5MUDr. Karel Mencl, CSc.
1Nemocnice České Budějovice, a. s., Centrální laboratoře, Laboratoř parazitologie a mykologie
2Univerzita Palackého v Olomouci, Lékařská fakulta a Fakultní nemocnice Olomouc, Ústav mikrobiologie
3Fakultní nemocnice Brno, Oddělení klinické mikrobiologie
4Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice Hradec Králové, Ústav klinické mikrobiologie
5Pardubická krajská nemocnice, a. s., Oddělení klinické mikrobiologie
e-mail: mallatova@nemcb.cz

