V léčbě se uplatňuje mimo jiné řada látek ze skupiny perorálních antidiabetik. Autoři tohoto článku se snaží podat co možná nejucelenější přehled dnes běžně užívaných látek a dovolují si poukázat i na možné budoucí cesty, kterými se bude vývoj antidiabetik ubírat.
Summary
Slíva, J., Horáková, L., Patočková, J. Current and maybe future oral antidiabetics
Diabetes mellitus type 2 is a chronic disease with continuously increasing prevalence and incidence. This is associated with an immense burden in both health and social system. There are many drugs used in the therapy, among others oral antidiabetics. The authors try to summarize the most frequently used drugs as well as they show the possible future ways of development of substances with innovative mechanism of action.
Diabetes mellitus je onemocnění, jehož výskyt v populaci má obecně rostoucí charakter. O tomto trendu ostatně svědčí i data z dynamických tabulek připravených na základě programu DPS (Data Presentation System), vyvinutého ve spolupráci se Světovou zdravotnickou organizací (WHO), která jsou prezentována Ústavem zdravotnických informací a statistiky (ÚZIS). Zatímco v roce 2000 je prevalence diabetes mellitus u žen v České republice 6788,6 a u mužů 5 932,3 případu na 100 000 obyvatel, v roce 2007 se jednalo již o 7658 žen a 6870,6 muže. Evidentně se rovněž zvýšila incidence, a sice z 512,5 případu v roce 2000 na 546,3 případu v roce 2007.
Neméně zajímavé jsou rovněž údaje týkající se struktury diabetiků podle nastavené léčby. V populaci tak na 100 000 obyvatel bylo v roce 2007 pouze na dietě 1980,4 muže a 2323 žen, perorální antidiabetika užívalo 3156,8 muže a 3444,4 ženy, inzulínová léčba byla indikována u 1182,2 muže a u 1 244,7 ženy a kombinovaná léčba u 551,3 muže a 645,9 ženy.
Nebývale rostoucí počet diabetiků nepochybně není typický pouze pro Českou republiku, ale upozorňuje na něj i Světová zdravotnická organizace. Podle jejích odhadů celosvětový počet diabetiků již přesáhl 180 milionů obyvatel a nadále roste. V roce 2030 by tak tento počet mohl být přibližně více než dvojnásobný. V roce 2005 v souvislosti s touto nemocí na celém světě zemřelo přibližně 1,1 miliónu osob, přičemž až 80 % těchto úmrtí je udáváno v zemích se středně nízkým až nízkým HDP. Téměř k polovině těchto úmrtí dochází u osob ve věku do 70 let, přičemž v cca 55 % se jedná o ženy. Z dalších odhadů WHO vyplývá, že v roce 2015 by počet úmrtí v souvislosti s diabetem v rozvinutých zemích mohl oproti roku 2015 narůst o více než 80 %. Diabetes mellitus je ze své povahy chronické onemocnění, které vyžaduje nejenom ze zdravotního, ale též sociálního systému nemalé finanční zdroje. Podle odhadů se jedná až o 20 miliard Kč ročně, přičemž nejvíce nákladů je vynakládáno na léčbu chronických komplikací. Z panevropské analýzy situace v osmi zemích, publikované bezmála před 7 lety, vyplývá, že na jednoho diabetika je v průměru ročně vynaloženo 2834 eur.
Největší část připadne na hospitalizaci (55 %), naopak nejnižší náklady se týkají antidiabetické medikace (7 %).(1) Antidiabetická farmakoterapie se dnes sestává z využití terapeutického potenciálu perorálních antidiabetik (PAD) a inzulínu, respektive inzulínových analog. V následujícím textu bude pojednáno o základních charakteristikách nejdůležitějších zástupců jednotlivých skupin PAD s přihlédnutím k aktuálně registrovaným přípravkům v České republice (dle AISLP 2009.2) a současně naznačíme další možné směřování ve vývoji některých nových substancí s antidiabetickým potenciálem.
Klasifikace perorálních antidiabetik
1. Deriváty sulfonylmočoviny (též deriváty sulfonylurey)
2. Biguanidy
3. Inhibitory alfa-glukosidázy
4. Thiazolidindiony (též glitazony)
5. Glinidy (též meglitinidy či nesulfonylureová sekretagoga)
6. PAD ovlivňující inkretinový systém
a. gliptiny (též inhibitory dipeptidylpeptidázy 4 (DPP-4) či inkretinoenhancery)
b. inkretinomimetika
7. Ostatní
Deriváty sulfonylmočoviny (sulfonylurey)
Charakteristika
Deriváty sulfonylurey byly historicky prvními perorálními antidiabetiky. Jejich hypoglykemizující účinky objevili náhodně při výzkumu sulfonamidů Janbon a kol. v roce 1942. Tolbutamid, první široce užívané perorální antidiabetikum, byl na trh uveden v 50. letech minulého století. V historickém, fyzikálně-chemickém i klinickém kontextu členíme tuto rozsáhlou skupinu perorálních antidiabetik na tři generace. Současná klinická praxe využívá zejména přípravky 2. generace: glibenklamid, gliklazid, glipizid, gliquidon. Využíván je rovněž glimepirid, jenž je pro odlišnost své vazby na specifický receptor řazen do 3. generace.
Mechanismus účinku a farmakodynamika
Vliv derivátů sulfonylurey na snižování hyperglykémie je zprostředkován především zvýšením inzulínové sekrece (inzulínová sekretagoga). Toho dosahují působením na specifické vysokoafinitní sulfonylureové receptory beta-buněk pankreatu, jejichž prostřednictvím blokují membránové ATP-senzitivní K+-kanály, dochází k depolarizaci a následné aktivaci napěťově řízených Ca2+-kanálů. Zvýšení intracelulární hladiny vápníku aktivuje sekreční granula již vytvořeného inzulínu. Glimepirid se váže na jiný protein sulfonylureového receptoru, ale vyvolává stejný sled reakcí jako ostatní deriváty. Podmínkou účinku všech derivátů sulfonylurey je zachovaná schopnost produkce inzulínu. Léčba selhává v případě dlouhotrvající hyperglykémie, kdy je vyčerpán inzulín ze sekrečních granul. Při delším podávání derivátů sulfonylurey je třeba počítat se snížením sekretorické odpovědi, důvodem může být malá reziduální sekreční kapacita beta-buněk a down-regulace receptorů. Počet receptorů se snižuje s rostoucí dávkou. Mimoto se deriváty sulfonylurey různou měrou podílí na apoptóze beta-buněk.(2) Komplexní působení sulfonylurey dále zahrnuje zvýšení citlivosti tkání vůči inzulínu a snížení hladiny sérového glukagonu (potlačení jaterní glukoneogeneze a sekrece).
Kromě toho sulfonylmočovinové deriváty snižují riziko mikroi makrovaskulárních komplikací u vysoce rizikových pacientů.(3, 26) Gliklazid společně s glimepiridem vykazují antiagregační působení a mohou tak mít ochranný vliv na mikrocirkulaci. Glimepirid zvyšuje plazmatickou hladinu adiponektinu a přispívá ke zvýšení koncentrace HDL.(4)
Bezpečnost, snášenlivost a lékové interakce
Deriváty sulfonylurey se ve své dlouholeté klinické praxi osvědčily, jsou obvykle dobře tolerovány.
Významným nežádoucím účinkem derivátů sulfonylurey je hypoglykémie. Jedná se o vážný, život ohrožující a často špatně diagnostikovaný stav s mortalitou do 10 %.(5) V incidenci hypoglykémie mezi jednotlivými látkami existují rozdíly dané především délkou eliminačního poločasu a přítomností či nepřítomností aktivních metabolitů.(27) Frekventovanější výskyt hypoglykémie je u pacientů podstupujících agresivní antidiabetickou terapii a u pacientů užívajících dlouhodobě působící deriváty sulfonylmočoviny, např. glibenklamid.(6) Předpokládá se, že na zvýšeném riziku hypoglykémie se podílí geneticky determinovaná nízká aktivita CYP2C9.(7) K méně závažným nežádoucím účinkům derivátů sulfonylurey patří nevolnost, fotosenzitivita či alergické kožní reakce. Léčbu může provázet zvýšení tělesné hmotnosti. Vzácněji dochází ke zvýšení hodnot jaterních enzymů a hematologickým poruchám. Deriváty sulfonylurey jsou stále podezřívány z podílu na vzniku kardiovaskulárních příhod; v tomto ohledu se jeví bezpečnější novější látky, např. glimepirid.(8) Na druhou stranu bylo prokázáno, že glimepirid, gliklazid [ADVANCE study(26)] a glibenklamid nepůsobí jako rizikové faktory ischemické choroby srdeční.(9) Interakce derivátů sulfonylurey jsou především farmakokinetické povahy.
Hypoglykemizující účinek mohou zvyšovat látky, které vykazují podobně jako deriváty sulfonylurey vysokou vazebnost na plazmatické bílkoviny a mohou o vazebná místa kompetovat (nesteroidní antiflogistika). Antacida [Mg(OH)2, Al(OH)3] zvyšují biologickou dostupnost a hypoglykemizující odpověď glibenklamidu a glipizidu. Flukonazol v kombinaci s glibenklamidem a glimepiridem zvyšuje riziko hypoglykémie. Podobně působí ciprofloxacin. Rifampicin naopak snižuje biologickou dostupnost perorálních antidiabetik a může zhoršit kompenzaci diabetu. Glibenklamid, gliklazid a gliquidon mohou prodloužit účinek barbiturátů, hypnotik a sedativ.
Kontraindikace
Tyto látky jsou kontraindikovány při těžké jaterní a renální insuficienci pro možnost kumulace léčiva s následnou protrahovanou hypoglykémií. Nepodávají se při juvenilním a nestabilním diabetu, onemocnění štítné žlázy a v těhotenství. Přestup do mateřského mléka je minimální, nicméně kojenci by měli být monitorováni kvůli případným projevům hypoglykémie.(10)
Nejdůležitější zástupci
Deriváty sulfonylurey nacházejí uplatnění především v kombinované terapii s metforminem, jde o alternativu (léky druhé volby) při nedostatečné kompenzaci diabetu 2. typu po monoterapii metforminem. Léčiva se podávají v nejnižších možných dávkách 1–2krát denně, vysoké dávky mohou jejich účinek paradoxně snižovat. Níže jmenovaní zástupci jsou dostupní na českém trhu (Tab. 1).
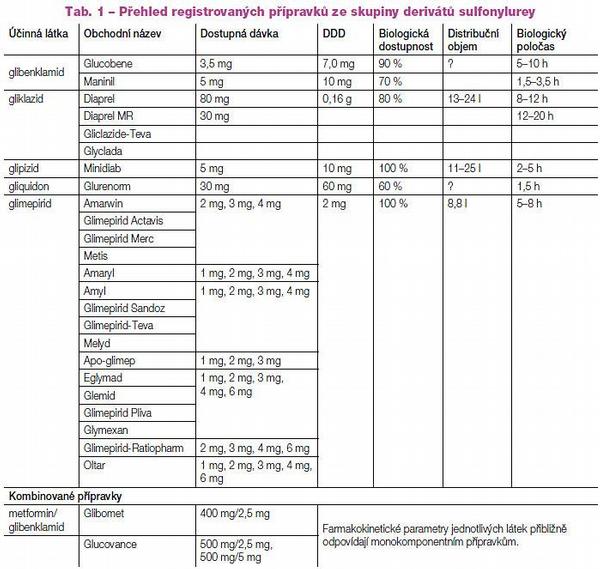
Glibenklamid
Chemický název (IUPAC): N-[2-[4- dec-1-yl)amino]acetyl]pyrrolidine-2-carbonitril
Sumární vzorec: C17H25N3O2
Molekulová hmotnost: 303,40 g/mol
Vildagliptin se po perorálním podání velmi dobře vstřebává, přičemž maximálních plazmatických koncentrací je dosaženo přibližně za 1,7 hodiny (současný příjem potravy absorpci poněkud prodlužuje). Biologická dostupnost činí 85 %. Na bílkoviny krevní plazmy se váže pouze omezeně (9,3 %); distribuční objem činí 71 l. Z těla je vylučován především ve formě svých metabolitů (zejména LAY 151), přičemž není metabolizován systémem cytochromu. Vylučování se odehrává především cestou ledvin (85 %); biologický poločas činí 3 hodiny.
Vildagliptin je stejně jako sitagliptin využíván v léčbě diabetes mellitus 2. typu jako PAD určené do kombinace s metforminem, deriváty sulfonylurey či thiazolidindionem. Zatímco při kombinaci s metforminem či thiazolidindionem je doporučená denní dávka 100 mg podávaná rozděleně ve 2 dávkách po 50 mg ráno a večer, při podávání v kombinaci s derivátem sulfonylurey je doporučená dávka 50 mg jednou denně ráno. U pacientů s mírnou renální nedostatečností (clearance kreatininu ? 50 ml/min) není nutno dávkování upravovat.
Inkretinomimetika neboli agonisty GLP-1R uvádíme pouze pro úplnost, neboť se nejedná ani o PAD, ani o inzulíny či jejich analoga. Z této lékové skupiny je tč. v České republice registrován exenatid, původně popisovaný jako součást ještěřího jedu. Dostupný je v přípravku Byetta ve formě injekčního roztoku určeného pro subkutánní aplikaci v množství 5 či 10 µg u diabetiků 2. typu v kombinaci s metforminem a/nebo deriváty sulfonylurey. Látka liraglutid není – podobně jako třeba albiglutid – prozatím registrována.
Ostatní PAD a antidiabetika ve fázi preklinického či klinického výzkumu
Z předchozí skupiny je jistě zajímavý i saxagliptin, který v kombinaci s dapagliflozinem vyvíjí společnost Bristol-Myers Squibb ve spolupráci se společností Astra Zeneca. Saxagliptin je však rovněž vyvíjen i do monokomponentního užití – nedávno byla prokázána jeho účinnost, jestliže byl podáván diabetikům 2. typu společně s metforminem.(24) Zatímco molekula saxagliptinu působí jako inhibitor DPP-4, dapagliflozin je inhibitorem sodíkoglukózového kotransportéru 2 (SGLT2) v proximálních tubulech ledvin, čímž výrazně omezuje intenzitu zpětného vstřebávání glukózy z primární moči. Mezi látky se stejným mechanismem účinku se řadí též remogliflozin či sergliflozin. Princip celé této nové skupiny gliflozinů je založen na skutečnosti, že reabsorpce glukózy ledvinami je sice výhodou z evolučního hlediska pro lepší hospodaření s energií, avšak u diabetika 2. typu pouze podporuje hyperglykémii a zvyšuje tak riziko sekundárních komplikací diabetu.
Zatímco u látek ovlivňujících inkretinový systém se předpokládá do budoucna velká účast na farmaceutickém trhu, v souvislosti s další vyvíjenou molekulou jsou takové odhady zmiňovány spíše poskrovnu. Touto látkou je o modulátor receptorů PPAR-?, tedy skupiny receptorů ovlivňovaných rovněž mj. též glinidy, metaglidasen.
Neméně zajímavou molekulou je rovněž pramlintid acetát (Symlin), prozatím jediný zástupce tzv. amylinomimetik. Jedná se o ekvipotentní syntetický analog lidského amylinu, který napomáhá kontrole postprandiální glykémie, a to omezením sekrece glukagonu, zpomalením vyprazdňování žaludku a tím i zpomalením absorpce glukózy ze střeva, a nakonec i pozitivním ovlivněním centra sytosti v mozku. Jeho subkutánní aplikace u pacientů s diabetem 1. či 2. typu je provázena poklesem hladiny HbA1c o 0,29–0,39 % a navíc i mírným snížením tělesné hmotnosti.(25)
Nejlépe však uvidíme sami, čím nás farmakoterapie diabetu nakonec překvapí. Jistě řada z nás si vybavuje velké naděje vkládané do tzv. glitazarů (např. muraglitazar či tesaglitazar), tedy duálních agonistů PPAR receptorů, nabízejících možnost současného ovlivnění receptorů ? a ? – tedy jakási kombinace účinků fibrátů a glinidů. Naděje byly nakonec vystřídány velkým zklamáním, jehož příčinou byl výskyt závažných nežádoucích účinků. Nejnověji je hodnocena látka aleglitazar. Ve vývoji jsou dále např. látky působící jako inhibitory glykogenolýzy či modulátory/aktivátory glukokinázy.
O autorovi: 1, 2MUDr. Jiří Slíva, 1Mgr. Lenka Horáková, 1MUDr. Jitka Patočková, Ph. D.
1Univerzita Karlova v Praze, 3. lékařská fakulta, Ústav farmakologie
2Univerzita Karlova v Praze, 2. lékařská fakulta, Ústav farmakologie











