Úspěch první registrované protilátky (anti CD20, rituximab; Mabthera) v indukční i udržovací léčbě B-nehodgkinských lymfomů podnítil prudký rozvoj imunoterapie. Snaha o rozšíření spektra účinku vedla k syntéze protilátek s nižší imunogenicitou, které jsou zaměřené proti různým dalším antigenům lymfoidních a myeloidních buněk. Díky konjugaci protilátky a radioizotopu se zrodil koncept radioimunoterapie. Byl učiněn pokrok v chápání mechanismů účinku i příčin selhání léčby monoklonálními protilátkami. Cílem sdělení je poskytnout přehled o klinicky relevantních monoklonálních protilátkách a jejich současných léčebných aplikacích.
Summary
Procházka, V., Papajík, T., Szotkowski, T., Kubová, Z., Rusiňáková, Z., Indrák, I. Targeted treatment of hematooncological diseases with monoclonal antibodies
Targeted monoclonal antibody therapy is an integral part of modern hematooncological treatment. Targeting of therapy to specific antigen on the surface of tumor cells led to a significant increase in treatment efficacy and at the same time to a reduction of its toxicity. Success of the first registered antibody (anti CD20, rituximab, MabThera) in the induction and maintenance treatment of B-Non-Hodgkin lymphomas stimulated rapid development of immunotherapy.
Efforts to expand the range of action led to the synthesis of antibodies with less immunogenicity, which are directed against various other antigens of lymphoid and myeloid cells. Thanks to conjugation of an antibody and a radioisotope the radioimmunotherapy concept was created. Progress has been made in understanding the mechanisms of action and the causes of failure of treatment with monoclonal antibodies. This article aims to provide an overview of clinically relevant monoclonal antibodies and their current treatment applications.
Úvod
(Vít Procházka)
Imunita představuje jeden ze základních homeostatických systémů organismu. Evoluce v rozpoznávání vlastních buněk a buněk cizorodých – změněných infekčním agens či nádorovým bujením – dospěla od pohotových, avšak méně účinných mechanismů nespecifické imunity k imunitě specifické, společné všem obratlovcům. Středobodem reakcí specifické imunity je schopnost organismu rozpoznat cizorodý antigen a iniciovat tvorbu molekul imunoglobulinu s vysokou specificitou a aviditou k rozpoznanému antigenu (monoklonálních protilátek).
Prvním z řady vědců, kteří přispěli počátkem 20. století k pochopení mechanismů specifické imunity, byl německý chemik a mikrobiolog Paul Ehrlich. Jeho idea „magického projektilu“ jako substance schopné neutralizovat toxiny a baktérie byla vizionářská a pozoruhodně blízko skutečné podstatě protilátek.(1) Pochopení produkce monoklonálního imunoglobulinu bylo úzce spjato s výzkumem nádorového klonu buněk mnohočetného myelomu. Produkci monoklonálních protilátek, tak jak je známe dnes, umožnil objev hybridomů (1975), za který byli Georges Köhler, César Milstein a Niels Kaj Jerne oceněni Nobelovou cenou. Principem hybridomů je vytvoření imortalizovaných linií buněk vzniklých fúzí buněk myelomu a imunizovaných B-lymfocytů ze sleziny myší.(2)
Osvojení technik produkce a purifikace monoklonálního imunoglobulinu umožnilo prudký rozvoj nejen imunologické diagnostiky, ale i léčebné aplikace monoklonálních protilátek. Konec 90. let pak přinesl novou naději i pro onkologické pacienty. V roce 1998 schválil americký regulační orgán (US Food and Drug Administration) první monoklonální protilátku (anti-CD20, rituximab) pro klinické využití v terapii nehodgkinského lymfomu. Začala éra cílené imunoterapie nádorů, která díky dosahovaným úspěchům zcela změnila osud nemocných s lymfoidními malignitami.
Struktura a klasifikace protilátek
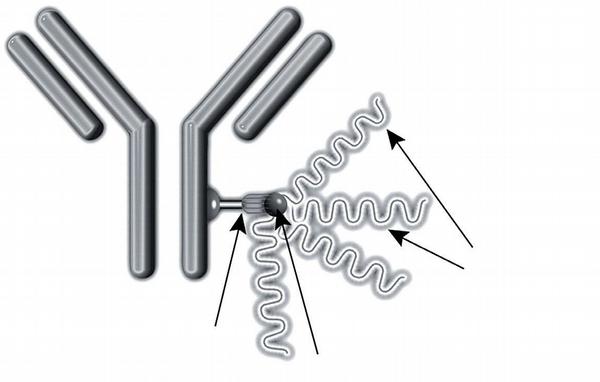
Molekula imunoglobulinu třídy G (IgG) je heterodimer skládající se z 2 typů polypeptidových řetězců: těžkého (50 kDa) a lehkého (25 kDa). Lehké řetězce existují ve 2 typech: kappa a lambda. Pomocí enzymu papainu mohou být z molekuly odštěpeny tzv. Fab fragmenty, které obsahují hypervariabilní domény umožňující vázat antigen. Zbývající část imunoglobulinu (Fc fragment) váže Fc receptor cytotoxických lymfocytů, a tím výrazně potencuje jejich účinek na cílovou buňku. Hovoříme o buněčné cytotoxicitě závislé na protilátkách (antibody-dependent cellular cytotoxicity, ADCC), která je v imunoterapii nádorů klíčová.
Monoklonální protilátky mohou být v současnosti syntetizovány řadou metod. Podle přítomnosti humánních nebo myších komponent imunoglobulinové molekuly dělíme protilátky na myší, chimerické, humanizované a plně humánní. Myší protilátky získané hybridomovou technologií označujeme příponou -omab. Hlavním problémem v jejich využití je omezená aktivace ADCC a rychlá imunizace příjemce s tvorbou protilátek (human anti-mouse antibodies, HAMA). Snaha o odstranění imunogenicity vedla k syntéze nejprve chimerických (-ximab) a humanizovaných (-zumab) protilátek.
Chimerické protilátky obsahují variabilní část molekuly myší a konstantní část lidskou. Humanizované protilátky mají dále redukovánu myší část molekuly jen na hypervariabilní sekvence imunoglobulinové molekuly – je tak dosaženo až 95% shody se strukturou lidského imunoglobulinu. Plně humánní protilátky (-mumab) jsou produkovány pomocí transgenních myší. Humánní část genomu kódující syntézu molekuly imunoglobulinu je transferována do genomu myší, které jsou následně imunizovány antigenem.
Mechanismy účinku protilátek
Přesný in vivo mechanismus účinku monoklonálních protilátek není dosud objasněn. Na základě řady in vitro experimentů nejlépe studované protilátky (rituximab) byly definovány 3 základní mechanismy (Obr. 1).
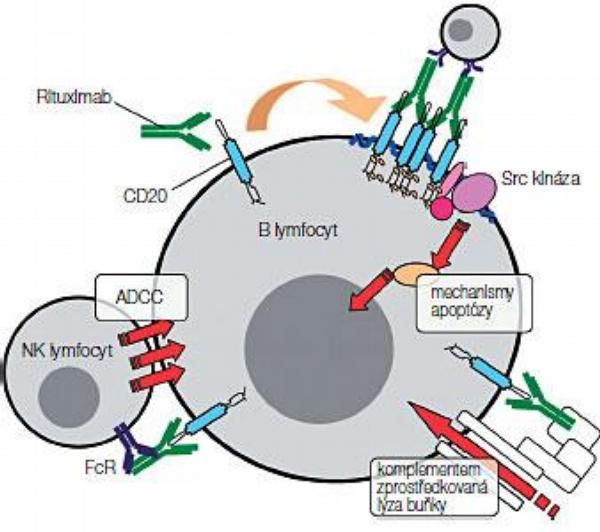
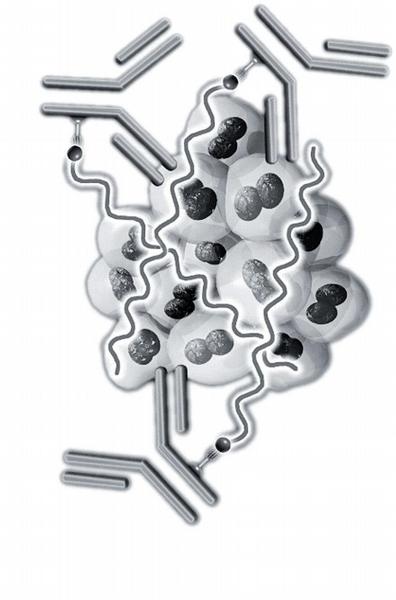
Patří mezi ně komplementem zprostředkovaná cytotoxicita (complement-dependent cellular cytotoxicity, CDC), cytotoxicita závislá na protilátkách (antibody-dependent cellular cytotoxicity, ADCC) a přímá indukce apoptózy.(3) ADCC je realizována vazbou efektorových buněk imunitního systému (NK-buňky, neutrofilní granulocyty a makrofágy) na Fc fragment navázané protilátky. Tato vazba iniciuje uvolnění obsahu cytotoxických granul NK buněk a produkci cytokinu TNF, což vede k apoptóze cílové buňky.
Fc fragment je rozpoznáván také C1q komponentou komplementu a dochází ke spuštění klasické cesty aktivace komplementu s tvorbou lytických pórů v membráně buňky (CDC). Přímá indukce apoptózy je pravděpodobně nejkomplexnější reakcí buňky na monoklonální protilátku. Prostřednictvím vazby na antigen (receptor) na povrchu dojde k aktivaci kaskády nitrobuněčných signálních drah, které ve svém důsledku vedou ke smrti nádorové buňky. Existuje řada důkazů o proapoptotickém působení rituximabu na subcelulární úrovni – například prostřednictvím snížené exprese antiapoptotických genů (Bcl-2, Bcl-(xL) a Mcl-1) a zvýšením exprese Fas ligandu na povrchu buněk. Protilátkami indukovaná apoptóza navíc není, na rozdíl od působení řady konvenčních cytostatik, zcela závislá na funkční dráze apoptotického proteinu p53. Uvedená pozorování mají dalekosáhlý klinický význam: protilátky mohou být účinné i u chemorezistentních forem nádorů a co více, mohou naopak vést k obnovení chemosenzitivity a zvýšení radiosenzitivity nádoru.(4, 5, 6)
Faktory ovliňující účinnost imunoterapie
Interakce mezi antigenem nádorové buňky a monoklonální protilátkou je vemi komplexní proces. Efektivita celého procesu je v praxi modifikována řadou faktorů jak ze strany pacienta a tumoru, tak vlastnostmi a farmakokinetikou samotné protilátky (Obr. 2).
K optimální efektivitě protilátky je nutné, aby na nádorové buňce byly receptory antigenu v dostatečné hustotě a aby byla protilátka podána v dostatečné koncentraci. V ideálním případě by všechna vazebná místa pro antigen měla být protilátkou vysycena. Velká nádorová masa tumoru (bulk), přítomnost volného cílového antigenu v plazmě či suboptimální koncentrace protilátky účinnost léčby snižují.(8)
Pro samotnou interakci antigen/protilátka je významný polymorfismus genů kódujících Fc receptory efektorových buněk. Dimorfismus genu FCGR3A, kódující na pozici 158 aminokyselinu fenylalanin (Fc?RIIIa-158F) nebo valin (Fc?RIIIa-158V), vede k různé síle vazby na antigen a různé míře aktivace efektorových buněk. Bylo zjištěno, že lymfocyty homozygotů (valin/valin) byly schopny lýzy tumoru při 4,2krát nižších koncentracích rituximabu než lymfocyty s F/F genotypem. Při dostatečných koncentracích rituximabu se rozdíl v cytotoxickém potenciálu obou subtypů stíral.(9, 10) Efektivní imunoterapie není možná bez přítomnosti dostatečného počtu efektorových buněk (NK lymfocytů), které se podílejí na ADCC. Opakovaně bylo prokázáno, že lymfopenie je silný nepříznivý faktor u pacientů léčených imunochemoterapií s rituximabem.(11, 12)
Monoklonální protilátky v léčbě nehodgkinských lymfomů
Rituximab a další protilátky proti CD20 antigenu
(Vít Procházka)
Rituximab je chimerická monoklonální protilátka typu IgG1 specificky namířená proti CD20 antigenu, který je exprimován na zralých fyziologických lymfoidních buňkách B-řady a s různou denzitou i na buňkách téměř 90 % maligních B-lymfomů. Zavedení monoklonální protilátky rituximabu do klinické praxe znamenalo významný pokrok především v terapii lymfoproliferativních chorob. Ukázalo se, že díky minimální toxicitě jej lze vhodně kombinovat s dosud používanými protokoly chemoterapie – začala úspěšná éra imunochemoterapie. Jednou z prvních randomizovaných studií, ve kterých prokázal tento koncept svůj pozitivní léčebný přínos, byla studie francouzské skupiny GELA.(13)
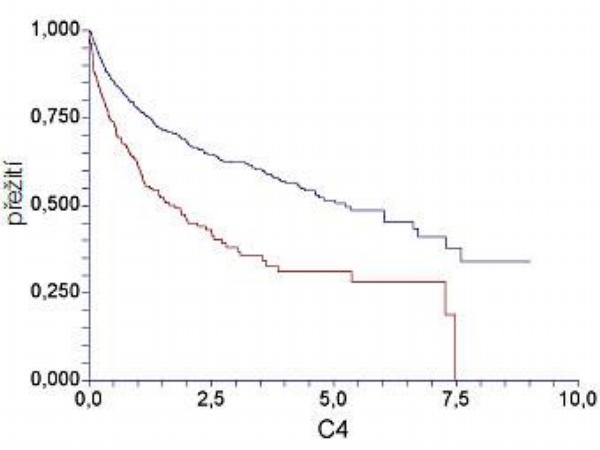
V populaci nemocných ve věku 60–80 let bylo srovnáváno 6 cyklů chemoterapie (CHOP) podaných v jednadvacetidenním intervalu (CHOP-21) se stejným režimem obohaceným o rituximab (R-CHOP-21). V rameni s rituximabem dosáhlo celkové přežití (overall survival, OS) v 5 letech 58 % ve srovnání se 45 % v rameni bez rituximabu. Přínos rituximabu byl potvrzen populační studií L. Sehnové i na neselektované populaci nemocných v Britské Kolumbii (Obr. 3).(14)
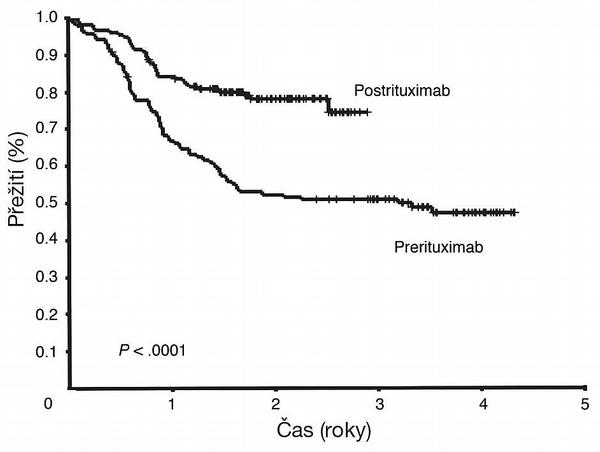
Ve studii byly srovnávány léčebné výsledky populace 292 nemocných s DLBCL léčených CHOP a CHOP-podobným režimem před a po zavedení rituximabu. Léčba imunochemoterapií vedla k významnému prodloužení přežití nemocných ve všech věkových skupinách – v populaci starších pacientů došlo ke zlepšení 2letého přežití o přesvědčivých 26 % (52 % vs. 78 %, p < 0,0001). Podání rituximabu zlepšuje přežití také u vysoce rizikových nemocných s agresivním lymfomem, pokud jsou léčeni dostatečně intenzívními protokoly léčby.
Tento postup s následnou vysocedávkovanou chemoterapií je vysoce efektivní a bezpečný.(15, 16) Účinnost samotného rituximabu(17) i jeho kombinace s chemoterapií byla potvrzena v řadě prospektivních randomizovaných klinických studií i u indolentních lymfomů.(18, 19) Vliv přidání rituximabu do indukční léčby na celkové přežití nemocných s folikulárním lymfomem a lymfomem plášťové zóny byl potvrzen i metaanalýzou.(20) Významným přínosem je také aplikace rituximabu v konsolidační „udržovací“ léčbě indolentních lymfomů.(21) Význam podání rituximabu byl dlouho sporný v případě B-chronické lymfatické leukémie – důvodem byla nízká denzita receptorů antigenu CD20 na povrchu nádorových buněk. Výsledky randomizované studie CLL-8 však přesvědčivě prokázaly převahu režimu s rituximabem (fludarabin + cyklofosfamid + rituximab, FCR) nad do té doby nejúčinnějším režimem FC, a to jak ve smyslu prodloužení bezpříznakového, tak i celkového přežití. Rituximab je u nemocných s B-CLL efektivní i u pacientů s nepříznivou genetickou změnou (delece 11q, nemutovaný stav IgVH) a vede k vyššímu procentu kvalitních remisí než režim FC.(22)
Nové protilátky zaměřené proti CD20 antigenu
(Vít Procházka)
Významný léčebný efekt rituximabu podnítil rozsáhlý preklinický výzkum, jehož cílem je vyvinout monoklonální protilátku schopnou s vyšší účiností aktivovat mechanismy buněčné i komplementem aktivované cytotoxicity. Jednou z cest je syntéza humanizovaných nebo humánních monoklonálních protilátek tzv. II. typu (tositumomab, GA101), které jsou v experimentu schopny navodit hlubší depleci B-lymfocytů než rituximab.(23) Navíc zatímco v případě protilátek I. typu (rituximab) je k efektivní lýze buňky nezbytná dostatečná denzita receptorů CD20 antigenu a aktivita komplementu, v případě II. typu protilátek tomu tak pravděpodobně není.
Nadějnou cestou ve vývoji imunoterapie je také syntéza genetickým inženýrstvím připravených multivalentních protilátek. In vitro studie bispecifické hexavalentní anti-CD20/22 protilátky ukazují její vysoký potenciál v aktivaci ADCC mechanismů i komplementem mediované lýzy buněk.(24) Vazba na dva antigeny současně navíc umožňuje zacílit imunoterapii na nádorový klon a zabránit tak nežádoucí depleci fyziologických B-lymfocytů.
Yttrium-90 (90Y)-ibritumomab tiuxetan (Zevalin®)
(Tomáš Papajík)
I přes dobrou účinnost monoklonálních protilátek v léčbě maligních nehodgkinských lymfomů existuje stále prostor pro zvýšení jejich protinádorového působení. Jednou z možností, jak zvýšit efektivitu samotné protilátky, je vazba s jinou látkou, která bude potencovat její protinádorový účinek. Maligní lymfomy totiž patří mezi vysoce radiosenzitivní nádory, a proto se přímo nabízí spojení – konjugace – monoklonální protilátky s vhodným radioizotopem a dopravení tohoto zářiče ke všem místům nádoru. Léčba pomocí protilátky konjugované s radioizotopem se obecně nazývá radioimunoterapie (RIT) a představuje zcela nový směr v léčbě nádorů.(25)
První monoklonální protilátkou konjugovanou s radioizotopem a schválenou pro rutinní klinické použití byl yttrium-90 (90Y)-ibritumomab tiuxetan (Zevalin®), který je dnes dostupný i pro pacienty v ČR.(26) 90Y-ibritumomab tiuxetan tvoří anti-CD20 myší IgG1? monoklonální protilátka, která je pomocí chelátoru tiuxetanu konjugovaná s radioizotopem 90Y (Obr. 4).(27)
Toto farmakum dokáže poškozovat a ničit nádorové buňky dvojím způsobem. Jednak přímou vazbou protilátky na povrchový antigen CD20 a jednak působením radioaktivního záření izotopu 90Y. Z hlediska mechanismu protinádorového účinku má 90Y řadu výhodných vlastností. Jde o čistý beta-zářič, což znamená, že neemituje žádné gama-záření.
Dosah záření je přitom z hlediska léčby lymfomů optimální – činí zhruba 5,3 mm. To u lymfomu představuje asi 100–200 buněčných průměrů. Spolu s vysokou energií emitovaných beta-částic (2,3 MeV) tak dokáže ničit i ty nádorové buňky, jež nejsou v přímém kontaktu se samotnou protilátkou. Tento účinek bývá označován jako efekt křížové palby (the cross-fire effect) (Obr. 5, 6).
Jeho další výhoda spočívá v tom, že jsou ničeny i nádorové buňky, jež nemusí nést na svém povrchu antigen CD20 (selektovaný CD20-negativní klon) a také buňky uvnitř větších nádorových mas, kam samotná protilátka nepronikne.(28) Poločas izotopu 90Y je 64 hodin (2,67 dne).
Volný izotop 90Y má tendenci se shromažďovat v kortikální oblasti kostí, což vysvětluje jeho myelosupresivní účinek. Díky krátkému poločasu rozpadu 90Y je útlum krvetvorby dočasný a dobře zvládnutelný současnou podpůrnou terapií.(25, 27, 28) Podání 90Y-ibritumomab tiuxetanu lze rozdělit na 2 etapy, mezi nimiž je týdenní pauza. Při první návštěvě je pacientovi ambulantně podán rituximab v dávce 250 mg/m2 v pomalé nitrožilní infúzi. Aplikace rituximabu blokuje volné CD20 antigeny v periferní krvi a na kolujících B-lymfocytech, čímž se dosáhne zlepšení biodistribuce 90Y-ibritumomab tiuxetanu. O týden později pacient přichází ke druhé infúzi rituximabu ve stejné dávce, po níž o 4 hodiny později následuje krátké nitrožilní podání 90Y-ibritumomab tiuxetanu v ČR na oddělení nukleární medicíny a za dodržení všech podmínek pro práci s radiofarmaky.(29)
Po aplikaci radiofarmaka je pacient krátce sledován a pokud je jeho klinický stav uspokojivý, může být propuštěn do domácího ošetřování. Protože 90Y neprodukuje gama-záření, neexistuje po aplikaci léku významné riziko radiační zátěže pro zdravotnický personál ani pro rodinné příslušníky či blízké osoby, které přijdou s nemocným do kontaktu. Hlavní toxicita 90Y-ibritumomab tiuxetanu je hematologická a bývá vyjádřena primárně trombocytopenií a granulocytopenií.(25, 27, 29) Tyto cytopenie dosahují hodnotového „vrcholu“ až za 4–8 týdnů po podání léku, což je významný rozdíl oproti obvyklému nástupu cytopenie po standardně podávané chemoterapii. 90Y-ibritumomab tiuxetan je schválen pro léčbu dospělých pacientů s CD20+ folikulárním lymfomem (FL) relabujícím po předchozí léčbě rituximabem a chemoterapií nebo u pacientů refrakterních, a to i včetně forem transformujících se do difúzního B-velkobuněčného lymfomu (DLBCL).
Další současnou indikaci představuje podání 90Y-ibritumomab tiuxetanu ke konsolidační léčbě u dříve neléčených pacientů s FL v remisi po indukční terapii.(30) Fáze I/II klinické studie s 90Y-ibritumomab tiuxetanem prokázala bezpečnost a efektivitu podání léku, když u nemocných s relabovanými a refrakterními lymfomy bylo dosaženo 67 % léčebných odpovědí (26 % kompletních remisí [CR] a 41 % parciálních remisí [PR]).(32) Ve fázi III randomizované klinické studie byla pak u nemocných s relabovaným či refrakterním nízce maligním lymfomem nebo s transformovaným lymfomem srovnávána účinnost léčby 90Y-ibritumomab tiuxetanem s podáním rituximabu.
Počet léčebných odpovědí a CR byl významně vyšší v rameni s RIT (počet odpovědí 83 % vs. 56 %, p = 0,002; CR 30 % vs. 16 %, p = 0,004).(33, 34) Řada dat dokumentuje výhody podání 90Y-ibritumomab tiuxetanu v rámci konsolidace předchozí chemoterapie nebo imunochemoterapie. Randomizovaná otevřená studie fáze III (FIT studie) srovnávala účinek konsolidace 90Y-ibritumomab tiuxetanem s prostým sledováním u nemocných s FL stadia III a IV, kteří podstoupili standardní chemoterapii v 1. linii léčby.(35)
Celkem bylo hodnoceno 414 pacientů a studie demonstrovala vysoký stupeň konverze z PR do CR v rameni s podáním 90Y-ibritumomab tiuxetanu ve srovnání s observačním ramenem (77 % vs. 18 %; p < 0,001). Celkově se efekt RIT projevil i v prodloužení doby do progrese choroby (PFS), a to jak v celém souboru nemocných (37 vs. 14 měsíců; p < 0,0001), tak i u nemocných v CR (55 vs. 30 měsíců; p = 0,01), resp. i v PR choroby po terapii 1. linie (30 vs. 6 měsíců; p < 0,0001). Klinické studie také potvrdily velmi dobrou léčebnou odpověď i u nemocných s relabujícím či primárně refrakterním DLBCL.(36)
Izraelští autoři zase dokumentovali významnou roli 90Y-ibritumomab tiuxetanu u mladších refrakterních nemocných s agresivním lymfomem, kdy byla RIT použita jako součást přípravného režimu (Z-BEAM) před autologní transplantací krvetvorných buněk.(37) 76 % pacientů dosáhlo CR choroby, celkové přežití ve 2 letech od výkonu bylo 67 %, PFS pak 52 %.
Alemtuzumab (MabCampath®) v terapii chronické lymfatické leukémie
(Zuzana Kubová)
Alemtuzumab je rekombinantní, monoklonální, humanizovaná IgG1 kappa protilátka namířená specificky proti antigenu CD52. CD52 je povrchový glykoprotein o velikosti 21–28 kD, který je fyziologicky exprimován B- a T-lymfocyty, monocyty, makrofágy, eozinofily a v malé míře také granulocyty a spermatozoi. Není přítomen v kmenových a progenitorových hematopoetických buňkách. Ve vysoké míře se nachází na nádorových B- i T-lymfocytech, denzita exprese CD52 antigenu na těchto buňkách tvoří přibližně 5 %. Alemtuzumab je původně odvozen od myší protilátky Campath-1.(38)
Následně byla z této protilátky extrahována hypervariabilní smyčka specifická pro CD52 a vložena do molekuly lidského imunoglobulinu IgG1 za vzniku protilátky Campath-1H, která slouží jako základ pro alemtuzumab.(39) Mechanismus indukce apoptózy lymfocytů je zprostředkováván pomocí fixace komplementu a na protilátce závislé cytotoxicitě.(40) Tím dochází k očekávané hluboké depleci lymfocytů, která může přetrvávat i několik měsíců po ukončení léčby. Pacient může být v této době ohrožen oportunními infekcemi, zejména cytomegalovirem a Pneumocystis jiroveci. Z tohoto důvodu je doporučována důsledná profylaktická protiinfekční terapie. V roce 2004 byly vypracovány postupy zabývající se prevencí a řešením nežádoucích účinků.(41)
Alemtuzumab byl původně schválen FDA (US Food and Drug Administration) pro léčbu chronické lymfatické leukémie (CLL) 2. linie u pacientů, kteří byli dříve léčeni alkylačními cytostatiky nebo u kterých selhala terapie fludarabinem. Monoterapie alemtuzumabem v této indikaci přinesla podle provedených studií velmi dobré výsledky, na léčbu odpovědělo 33–54 % pacientů a celkové přežití (OS) se pohybovalo v rozmezí 19–35 měsíců u pacientů odpovídajících na terapii, 16–27 % v celé kohortě, ve srovnání s jinými terapeutickými režimy, kde OS bylo menší než 12 měsíců.(42, 43, 44) V současné době byl alemtuzumab schválen, na základě příznivých výsledků ze studie fáze 3, také pro terapii 1. linie dříve neléčených pacientů s chronickou lymfatickou leukémií. Tato studie srovnává léčebný efekt alemtuzumabu versus chlorambucilu v 1. terapeutické linii.
Celková odpověď na terapii (ORR) činila 83 % vs. 56 %, p < 0,0001.(45) Ve shodě se studiemi s refrakterními/relabovanými pacienty bylo dosaženo lepších výsledků u pacientů s minimální či žádnou lymfadenopatií, což může být dáno horším průnikem alemtuzumabu do nádorové masy. Alemtuzumab naznačuje také svůj potenciál v kombinaci s jinými cytostatiky. V menších studiích byl hodnocen režim FluCam (kombinace fludarabinu s alemtuzumabem) u relabovaných/refrakterních pacientů, celková léčebná odpověď se pohybovala v rozmezí 65–83 %, OS 19–36 měsíců.(46) Kombinovaný režim fludarabin, cyklofosfamid, rituximab, alemtuzumab (CFAR) byl hodnocen u relabovaných, těžce předléčených pacientů, kde celková léčebná odpověď dosáhla 65 %. S režimem CFAR u dříve neléčených dosáhlo kompletní remise 71 % pacientů.(47, 48)
Alemtuzumab prokázal svou účinnost v konsolidaci po indukční terapii v dosažení MRD (minimal residual disease, minimální reziduální choroba) negativní remise onemocnění. MRD negativita v kostní dřeni vede k signifikantnímu prodloužení celkového přežití pacientů ve srovnání s MRD pozitivními pacienty. Italská skupina hodnotila 34 dříve neléčených pacientů s CLL, kompletní remise po indukční terapii dosáhlo 12 pacientů. Po konsolidaci alemtuzumabem se počet kompletních remisí zvýšil na 27, z toho 19 bylo MRD negativních.(49)
Alemtuzumab může být také užitečný v indukční terapii pacientů s vysoce rizikovými cytogenetickými abnormalitami, jako je delece chromosomu 17p, kteří mají signifikantně horší prognózu s mediánem přežití 9 měsíců, ve srovnání s nemocnými s jinými genetickými abnormalitami. Studie naznačují účinnost alemtuzumabu u těchto cytogeneticky vysoce rizikových nemocných.(50) Recentní studie hodnotí význam alemtuzumabu v prevenci reakce štěpu proti hostiteli v přípravném režimu před transplantací krvetvorných buněk. Alemtuzumab se pojí i s jinými oblastmi medicíny, v klinických studiích je hodnocen efekt v přípravném režimu před transplantací ledvin, v léčbě revmatoidní artritidy a sclerosis multiplex.
Alemtuzumab (MabCampath®) v terapii lymfomů z T-buněk
(Vít Procházka)
Alemtuzumab je testován i ve skupině nemocných, kteří z imunochemoterapie zatím neprofitovali – u pacientů s lymfomy z T-buněk. Podmínkou účinnosti alemtuzumabu je přítomnost CD52 antigenu na nádorových buňkách. Imunohistochemické stanovení CD52 je obtížné a ne zcela standardizované. Výsledky získané pomocí průtokové cytometrie ukazují, že exprese CD52 je téměř vždy přítomna u periferního T-lymfomu, blíže nespecifikovaného, angioimunoblastického lymfomu a kožního lymfomu z T-buněk.(51)
Imunochemoterapie byla s úspěchem podávána s režimem DHAP u relabovaných nemocných.(52) Velké očekávání nese evropská studie ACT (Alemtuzumab and CHOP in T-Cell Lymphoma), která testuje přínos imunochemoterapie A-CHOP (alemtuzumab + režim CHOP) v dávkově intenzívním režimu (cyklus á 14 dní) u nově diagnostikovaných nemocných. Studie má 2 varianty: ACT-1 (mladší nemocní, léčba zakončena autologní transplantací krvetvorných buněk) a ACT-2 (pro starší nemocné bez transplantace).(53, 54) V obou variantách budou nemocní randomizováni mezi ramenem A-CHOP-14 a CHOP-14.
Monoklonální protilátky v léčbě Hodgkinova lymfomu
(Zuzana Rusiňáková)
Úspěšná moderní léčba nemocných s Hodgkinovým lymfomem (HL) je založena na prognosticky stratifikované chemoterapii. Na základě dat německé studijní skupiny (studie HD9) dosahuje 10leté celkové přežití nemocných s pokročilým HL 75 % až 85 % podle typu chemoterapie.(55) Nejefektivnější protokol co do procenta nemocných bez relapsu i celkově přežívajících je chemoterapie BEACOPP (eskalovaná varianta). Vysoká úspěšnost léčby i obava ze sekundárních malignit vedou ke snaze o redukci celkových dávek cytostatik zavedením konceptu PET navigované léčby. Bylo zjištěno, že nemocní, kteří dosáhnou PET negativity časně po zahájení intenzívní léčby (po 2.–3. cyklu chemoterapie), mají výrazně lepší prognózu než pacienti, kteří jsou stále PET pozitivní.
Dosažení časné PET negativity nás pravděpodobně opravňuje k redukci dávek dalších cyklů chemoterapie. První nadějné výsledky použití této strategie byly nedávno publikovány českým kolektivem autorů.(56) Klinické využití monoklonálních protilátek je u pacientů s HL značně omezené – probíhá v rámci klinických studií u relabovaných a chemorezistentních nemocných. Výjimku představuje samostatná jednotka s indolentním průběhem: nodulární, predominantně lymfocytární Hodgkinův lymfom (NLPHD) s expresí CD20 antigenu na povrchu neoplastické populace buněk.
Výsledky fáze II studie použití rituximabu u pacientů s relabovaným a refrakterním NLPHD provedené německou skupinou pro HL dokazují vysokou efektivitu rituximabu (celková léčebná odpověď – ORR 94 %) u této skupiny pacientů.(57) Vzhledem k těmto povzbudivým výsledkům byla provedena studie zjišťující účinnost rituximabu v monoterapii v primární léčbě NLPHD klinického stadia IA (výsledky zatím nebyly publikovány).
Existuje několik mechanismů, pomocí kterých by rituximab podle in vitro testů měl být účinný i u pacientů s klasickým HL. Použití rituximabu vede k depleci B-lymfocytů podpůrného mikroprostředí NLPHD, což může vést i k navození buněčné smrti patologického klonu. Dále byl vysloven předpoklad, že 10–15 % nádorových buněk nese na svém povrchu antigen CD20 a umožnuje účinek rituximabu identický ostatním B-lymfoproliferacím. Klinická studie fáze II testovala účinnost rituximabu v kombinaci s chemoterapií (R-ABVD) pro nově diagnostikovaný HL klinického stadia II-IV. Podle závěrů této studie přidání rituximabu zlepšilo výsledky léčby dominantně u pacientů s iniciálně špatnou prognózou podle mezinárodního prognostického skórovacího systému (IPS 2 a více).
V současnosti probíhá randomizovaná multicentrická studie fáze III porovnávající efekt R-ABVD versus ABVD u pokročilého HL a studie HD 18 (multicentrická randomizovaná studie fáze III pro pacienty s pokročilým HL), jejíž součastí je i hodnocení efektu podání chemoterapie (BEACOPP eskalovaný) s rituximabem.(58) HCD122 – humanizovaná anti-CD40 monoklonální protilátka. Znak CD40 je standardně exprimován na povrchu nádorových buněk HL. Podání HCD122 indukuje cytotoxickou reakci závislou na protilátkách (antibody-dependent cellular cytotoxicity, ADCC) a blokuje růst nádorových buněk. Podle laboratorních pokusů inhibuje růst tumorů v porovnání s rituximabem o více než 50 %.
V současnosti probíhá fáze I/IIA studie HCD122 u pacientů s HL relabujícím minimálně po 2 liniích léčby.(59) Galiximab – humanizovaná IgG1 monoklonální protilátka (anti-CD80). Vazba galiximabu na CD80 (exprimovaném na povrchu nádorových buněk) vede rovněž k aktivaci ADCC. Aktuálně probíhá fáze II studie efektivity léčby s galiximabem u pacientů s relabovaným nebo refrakterním HL.
SGN-30 – chimerická anti-CD30 monoklonální protilátka specificky se vázající na receptor CD30, který může být hyperexprimován na povrchu buněk HL. Po vazbě na CD30 protilátka indukuje zástavu růstu a apoptózu nádorových buněk.
Vzhledem k předpokládanému synergickému efektu kombinace protilátky a chemoterapie (vycházející z in vitro testů) byl SGN-30 podáván v rámci klinických studií v kombinaci s gemcitabinem, vinorelbinem a doxorubicinem (GVD). Výsledky ale nepotvrdily signifikantní rozdíl v celkové odpovědi mezi skupinou GVD + protilátka versus GVD + placebo. Vzhledem k vývoji plicní toxicity u 20 % pacientů ve skupině s SGN-30, která nebyla pozorována v kontrolní skupině, byla studie ukončena a lék není zatím považován za dostatečně bezpečný.(60) HRS-3/A9 – bispecifická chimerická anti-CD30/CD16 protilátka se váže na nádorové buňky (CD30) a Fc receptor na povrchu NK-buněk a makrofágů indukující rozpad tumoru. V dávku eskalujících studiích fáze I/II bylo dosaženo ORR 13 %. U 60 % pacientů však došlo k tvorbě HAMA protilátek a léčbu nebylo možno opakovat. Navazující studie s posílením imunitní odpovědi pomocí aplikace interleukinu (IL-2) a růstových faktorů nepřinesly signifikantní zlepšení léčebných výsledků.(61)
Monoklonální protilátky v léčbě myeloidních malignit
(Tomáš Szotkowski)
Gentuzumab ozogamicin (Mylotarg®) Gentuzumab ozogamicin je rekombinantní humanizovaná monoklonální IgG4 protilátka namířená proti antigenu CD33, konjugovaná s antracyklinovým cytostatikem calicheamicinem. Protilátková část gentuzumab ozogamicinu, anti-CD33 hP67.6, je produkována buněčnou kulturou myelomové linie NS0, calicheamicin je produktem metabolismu baktérie Micromonospora echinospora subspecies calichensis.
Antigen CD33 je exprimován na povrchu nádorových buněk více než 80 % nemocných s akutní myeloidní leukémií. Nachází se také na normálních, neleukemických myeloidních prekurzorových buňkách, ne však na kmenových krvetvorných buňkách či na buňkách nehematopoetických.(62) Po vazbě gentuzumab ozogamicinu na antigen CD33 na povrchu buňky je celý komplex antigen-lék internalizován.
Calicheamicin je pak v lysosomech uvolněn, váže se na DNA, kterou poškozuje a způsobuje tak buněčnou smrt. Cytotoxické projevy vůči normálním myeloidním prekurzorům jsou reverzibilní, protože nejsou postiženy kmenové buňky krvetvorby. Podle doporučení České hematologické společnosti je gentuzumab ozogamicin jednou z možných modalit léčby na chemoterapii rezistentní CD33+ akutní myeloidní leukémie (AML).(63)
V USA je podání od roku 2001 schváleno pro léčbu CD33+ akutní myeloidní leukémie v 1. relapsu u nemocných ve věku 60 let a starších, kteří nebyli indikováni k chemoterapii.
Lék je podáván jako monoterapie v dávce 9 mg/m2 ve formě 2hodinové intravenózní infúze 1. a 15. den za monitorace vitálních funkcí, po premedikaci antihistaminikem a antipyretikem. Ke snížení zejména plicních nežádoucích účinků je doporučována předchozí cytoredukce hydroxyureou ke snížení počtu leukocytů pod 30x 109/l v době podání gentuzumab ozogamicinu.
Kromě výše uvedeného standardního schématu podání byl gentuzumab ozogamicin úspěšně kombinován s indukční, konsolidační i záchrannou léčbou AML.
U všech nemocných má podání tohoto léku výrazné myelosupresivní účinky. Dalšími možnými nežádoucími účinky jsou: hypersenzitivní reakce (včetně anafylaxe), horečka, třesavka navazující na infúzi; zvláště u nemocných s leukocytózou nad 30×109/l v době podání gentuzumab ozogamicinu a u nemocných s předchozím plicním onemocněním je zvýšené riziko těžkých plicních komplikací, jako jsou pleurální efúze, plicní infiltráty, plicní edém, syndrom dechové tísně dospělých (ARDS). Podání léku je také spojeno s rizikem hepatotoxicity včetně rozvoje venookluzívní nemoci jater, zejména u nemocných, kteří v minulosti podstoupili transplantaci krvetvorných buněk.
Účinnost a bezpečnost gentuzumab ozogamicinu byla analyzována ve studiích zahrnujících celkem 277 nemocných s CD33+ AML ve 3 skupinách (1997–2000).(64) Výsledky byly poměrně slibné, monoterapie vedla k celkem 26 % odpovědí trvajících přes 5 měsíců. Delšího přežití dosáhli nemocní, u nichž předchozí remise AML trvala déle než 1 rok, a také nemocní, kteří po podání Mylotargu dosáhli kompletní remise včetně plné regenerace tvorby trombocytů.
Již předběžné výsledky těchto studií vedly ke schválení preparátu americkým Úřadem pro potraviny a léky (US Food and Drug Administration). Vysoce účinný je tento lék také u akutní promyelocytární leukémie, při léčbě molekulárního relapsu dosáhli všichni nemocní po 3 dávkách gentuzumab ozogamicinu v monoterapii další molekulární remise.(65) Zatím chybí randomizované klinické studie, které by prokázaly prodloužení celkového přežití nemocných léčených chemoterapií s gentuzumab ozogamicinem.
Diskuse a závěr
(Vít Procházka)
Zavedení monoklonálních protilátek do léčby hematoonkologických malignit – zejména lymfomů – znamenalo impozantní nástup nové léčebné modality. Terapeutická úspěšnost rituximabu (MabThera®) a jeho tolerovatelná toxicita vedla díky kombinacím s původními protokoly chemoterapie ke vzniku nového konceptu imunochemoterapie. S úspěchem byl testován i koncept udržovací léčby protilátkou. Za poslední dekádu bylo jen rituximabem na celém světě léčeno léčeno 1,5 miliónu nemocných. Potenciál rituximabu v terapii nodálních B-nehodgkinských lymfomů vedl k snaze o aplikaci i u B-chronické lymfatické leukémie a Hodgkinova lymfomu.
V prvním případě s prokázaným úspěchem, ve druhém případě však zatím jde o experimentální postup. Schopnost rituximabu indukovat apoptózu i fyziologických B-lymfocytů vedla k efektivním aplikacím tohoto léku u řady autoimunitních onemocnění hematologické (autoimunitní cytopenie) i nehematologické povahy (revmatoidní artritida, sclerosis multiplex, lupus erythematodes).(66) Snaha o zvýšení potenciálu monoklonálních protilátek vedla ke konjugaci rituximabu s radioizotopem yttrium-90. Preparát (90Y)-ibritumomab tiuxetan (Zevalin®) prokázal svoji účinnost i u silně předléčených a chemorezistentních nemocných s folikulárním lymfomem.
Monoklonální protilátky proti dalším antigenům jsou v praxi úspěšné již jen omezeně. Velké naděje vkládané do alemtuzumabu (anti CD52) v terapii B-CLL snižuje značný myelosupresivní a imunosupresivní potenciál léku s rizikem řady oportunních infekcí. Alemtuzumab je nesmírně užitečný v případě léčby nemocných s delecí/mutací genu p53, avšak jeho léčebný efekt je často přechodný. Indikace alemtuzumabu v eradikaci minimální zbytkové nemoci u pacientů s B-CLL je stále experimentální a rizikový postup.
Kombinace chemoterapie CHOP a alemtuzumabu (A-CHOP) však může být novou nadějí pro nemocné s periferním T-lymfomem. Prospektivní multicentrická studie ACT-1 (mladší nemocní) a ACT-2 (starší nemocní) zkoumá přínos dávkově intenzívní chemoimunoterapie a bude iniciována i v ČR. V oblasti myeloidních malignit se šířeji zatím uplatnil pouze gentuzumab ozogamicin (Mylotarg®) – rekombinantní humanizovaná monoklonální IgG4 protilátka namířená proti antigenu CD33, konjugovaná s antracyklinovým cytostatikem calicheamicinem. Podle doporučení České hematologické společnosti ČLS JEP je Mylotarg® jednou z možných modalit léčby na chemoterapii rezistentní CD33+ akutní myeloidní leukémie.
Výsledky léčby monoklonálními protilátkami však nastolují i řadu otázek. I v případě nejúspěšnějšího preparátu – rituximabu – existuje až 30 % nemocných, kteří jsou na léčbu rezistentní.
Další zvýšení účinnosti imunochemoterapie se neobejde bez hlubokého vhledu do celého komplexu reakcí specifické protinádorové imunity.(67, 68)
Vztah mezi populací nádorových buněk a imunitním dozorem hostitelského organismu je velmi těsný a imunitní dohled pacienta je klíčový pro kontrolu růstu tumoru i pro účinnost chemoterapie. V éře léčby monoklonálními protilátkami správná „kooperace“ exogenní protilátky a cytotoxických mechanismů nemocného rozhoduje o léčebném výsledku více než kdykoliv dříve. Při léčbě monoklonálními protilátkami se neobejdeme bez aktivní spoluúčasti pacientovy celulární i humorální imunity. Variabilita léčebné odpovědi není zdaleka dána jen vlastnostmi tumoru, ale například i hladinou protilátky, polymorfismem genů kódujících Fc receptory i samotným počtem efektorových buněk realizujících ADCC. Tyto faktory dosud nebyly ve studiích dostatečně zohledněny.
Budoucnost bezpečné a maximálně efektivní léčby monoklonálními protilátkami je nutně spojena s maximálním využitím potenciálu specifické imunity nejen na straně humorální, ale i její buněčné složky. Rozvoj nádorového bujení je bez výjimky způsoben „únikem“ nádorových buněk imunitnímu dozoru organismu. Zpětné navození silné a dlouhodobé protinádorové imunity po léčbě lze tedy volně chápat jako moderní kauzální přístup k léčbě nádorových onemocnění.
Tato práce byla podpořena výzkumným záměrem MŠMT-MSM 6198959205.
O autorovi: MUDr. Vít Procházka, doc. MUDr. Tomáš Papajík, CSc., MUDr. Tomáš Szotkowski, MUDr. Zuzana Kubová, MUDr. Zuzana Rusiňáková, prof. MUDr. Karel Indrák, DrSc.
Univerzita Palackého v Olomouci, Lékařská fakulta a Fakultní nemocnice Olomouc, Hematoonkologická klinika
e-mail: vit.prochazka@fnol.cz











