Klíčová slova
mykoplazmové infekce • Mycoplasma pneumoniae • Mycoplasma hominis • Mycoplasma genitalium • Mycoplasma penetrans • Mycoplasma fermentans • Ureaplasma urealyticum
Mykoplazmata patří do zvláštní skupiny baktérií řazených do třídy Mollicutes (mollis - měkký, cutis - kůže), neboť se od ostatních baktérií liší specifickými vlastnostmi danými zejména tím, že netvoří peptidoglykan, a tím ani pevnou buněčnou stěnu. Představují nejmenší známý mikroorganismus schopný samostatného života. Mollicuta mají v přírodě široké spektrum hostitelů. Rod Acholeplasma se vyskytuje ve vodě a půdě, rod Spiroplasma je patogenní pro rostliny a hmyz, rod Thermoplasma byl nalezen v extrémně horkém prostředí doutnajícího uhlí.(1) Patogen, nyní známý jako M. mycoides, lišící se svými vlastnostmi od ostatních baktérií, byl v r. 1896 identifikován E. Nocardem a E. Rouxem jako agens vyvolávající pleuropneumonii u skotu.
První zpráva o mykoplazmatu jako příčinném agens u člověka, dnes známém jako M. hominis, se objevuje v r. 1937, kdy Dienes a Edsall izolovali organismus z abscesu Bartholinské žlázy.(2) Agens, vyvolávající lidskou primární atypickou pneumonii (PAP) a označované jako PPLO (pleuropneumonia-like organism), bylo uvedeno ve známost a charakterizováno ve 40. letech 20. století Eatonem.(3) Pro infekci člověka mají význam 2 rody (genera) - Mycoplasma a Ureaplasma z čeledi Mycoplasmataceae. Tyto 2 rody jsou společně označovány jako mykoplazmata. I když z lidí byly izolovány i jiné species, jejich role v lidské patogenezi není doposud dobře rozpoznána.
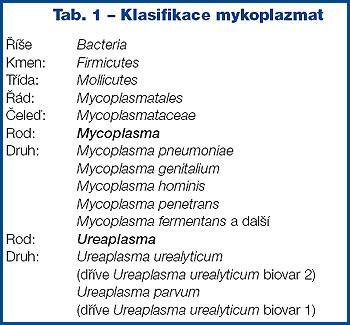
Z rodů Mycoplasma a Ureaplasma se u člověka vyskytuje několik druhů na sliznicích dýchacího a urogenitálního traktu. Druhy M. salivarium, M. buccale a M. orale fylogeneticky patří do skupiny M. hominis, jsou součástí normální flóry dutiny ústní, ale za určitých okolností, zejména při snížené imunitě, mohou hrát roli při onemocnění dutiny ústní, případně orofaryngu.
Pouze čtyři druhy mykoplazmat jsou patogenní pro člověka - Mycoplasma pneumoniae, primární patogen lidského respiračního traktu, a dále Mycoplasma hominis, Mycoplasma genitalium a Ureaplasma urealyticum, vyskytující se na sliznicích lidského genitálu. Nově bylo v r. 1991 zjištěno v moči u osob infikovaných HIV dosud nepoznané M. penetrans(4), M. pirum, M. fermentans a M. genitalium(5) (Tab. 1).
Popis a význam
Studium mykoplazmat a lepší znalost mechanismů virulence jsou důležité pro poznání chronických nemocí a poskytují další stupeň poznání v diagnostice a léčbě chorob vyvolaných těmito patogeny. Přehled chorob vyvolaných jednotlivými druhy mykoplazmat je uveden v Tab. 2.
Struktura genomu a fylogeneze mykoplazmat
V současnosti je známo 8 kompletních genomových sekvencí a 4 jsou ve vývoji. Genom tvoří cirkulární DNA o velikosti přibližně od 500 kb do 1400 kb. Z lidských mykoplazmat je znám kompletní genom u M. pneumoniae, M. genitalium(6), M. penetrans(7) a U. urealyticum(8).
Základní vlastnosti lidských zástupců mykoplazmat ukazuje Tab. 3.
Fylogeneze Mollicutes je zajímavá vzhledem k tvorbě genomu. Během evoluce se objevily mnohonásobné redukce jeho velikosti a byl pozměněn i genetický kód. Celkové tempo evoluce je necharakteristicky vysoké. Jediným předpokládaným významem redukce velikosti genomu je evoluce Mollicutes na striktní parazity, jejichž velká část metabolické mašinérie zakrněla. Mykoplazmata mají také jedinečné použití aminokyselinového kodonu UGA, který používají jako další kodon pro tryptofan, zatímco u ostatních organismů je stop-kodonem.
Od sekvenace těchto genomů se očekává vzestup poznání patofyziologie patogenu identifikováním faktorů virulence. Bude to užitečné pro identifikaci protektivních antigenů s možností vývoje vakcíny proti těmto parazitickým mikroorganismům a současně nápomocné při formování definice minimální buňky vzhledem k tomu, že genomy mnoha mykoplazmat již byly kompletně analyzovány.
Morfologie a metabolismus
Mykoplazmata jsou nejmenší volně žijící baktérie. Jejich velikost se pohybuje v rozmezí 0,2-0,8 mikro m a díky své značně fluidní membráně mohou procházet filtry používanými k odstraňování baktérií. Mají nejmenší genom i počet genů, takže postrádají některé metabolické dráhy, a proto pro izolaci i kultivaci vyžadují komplexní média. Mykoplazmata náleží mezi fakultativní anaeroby, vyjma M. pneumoniae, které je striktním aerobem. Od ostatních baktérií se odlišují chyběním buněčné stěny, a to jim umožňuje měnit tvar od kulovitého přes hruškovitý až k vláknitému.
Mykoplazmata rostou pomalu binárním štěpením a při kultivaci na agarových plotnách vytváří kolonie tvaru vaječného „volského oka“, kolonie M. pneumoniae mají granulární vzhled (Obr. 1). Vzhledem k pomalému růstu mykoplazmata vytvářejí kolonie během 3 týdnů a jsou obvykle velmi malé. Kolonie ureaplazmat jsou extrémně malé, takže jsou někdy nazývané jako T-kmeny („tiny strains“ = drobné kmeny).
Pro syntézu buněčné membrány a růst vyžadují steroly, resp. cholesterol. Tři kmeny lze diferencovat podle schopnosti metabolizovat glukózu (M. pneumoniae), arginin (M. hominis) nebo močovinu v případě Ureaplasma urealyticum. Čtvrtá species, M. genitalium, se dá extrémně obtížně kultivovat.
Mykoplazmata vzhledem k absenci buněčné stěny a současně značné plasticitě buněčné membrány zaujímají pleiomorfní tvar. Může být filamentózní i větvený, připomínající mycelia hub (odtud část názvu myko), kokovitý, sférický, granulární anebo mít na řezu tvar ploché lahve. Mykoplazmata se nejpravděpodobněji vyvinula z grampozitivních baktérií. Vzhledem ke svému značně redukovanému genomu nemohou uskutečňovat mnohé metabolické funkce, jako jsou tvorba buněčné stěny nebo syntéza purinů.
Metabolické aktivity jsou primárně více orientované na získávání energie než na získávání substrátů syntetickou cestou. Mollicuta postrádají cyklus trikarboxylových kyselin a mají omezené respirační systémy, takže je vyloučeno získávání ATP oxidační fosforylací. Podle schopnosti metabolizovat sacharidy se mollicuta dělí na fermentující a nefermentující. Fermentující využívají pro získávání ATP glykolytickou cestu a produkují laktát, event. acetylkoenzym A, kdežto nefermentující i některé fermentující species utilizují pro tvorbu ATP arginin v ornithinovém cyklu. Ureaplasma urealyticum a parvum se liší od ostatních mykoplazmat schopností utilizace močoviny urázou a tvorbou NH3 a CO2 a získáváním ATP chemiosmotickou cestou.(9)
Mykoplazmata jakožto mikroorganismy s výrazně redukovaným genomem, a tudíž i metabolismem, jsou považována za vynikající model „minimalizované buňky“. Buňky mykoplazmat obsahují minimální sadu organel představovanou plazmatickou membránou, ribosomy a vysoce kondenzovaným cirkulárním chromosomem. Pro vegetování mykoplazmat je nezbytné, aby byla schopná vázat se na hostitelské buňky a získávat z nich potřebné substráty. Mají pro tento účel vyvinutou speciální špičatou organelu (Obr. 2).
Obsahuje centrální tyčkovitou strukturu s vysokou koncentrací adhezinů nezbytných pro přilepení k hostitelské eukaryotické buňce. Tvorba adhezní organely je zajištěna významným procentem genů v mykoplazmovém genomu. Většina druhů mykoplazmat jsou extracelulárními patogeny. Některá z nich působí jako intracelulární patogeny, např. M. penetrans (jak naznačuje název), která pomocí této organely s fúzními proteiny pronikají do hostitelské buňky. Nepřítomnost rigidní buněčné stěny usnadňuje kontakt mezi mykoplazmatem a jeho hostitelskou buňkou, vytvořením možnosti fúze mezi oběma membránami. To umožňuje výměnu membrány i cytoplazmatických komponent.
Ekologie
Mykoplazmata jsou striktními parazity, nevyskytují se volně. Parazitují na širokém okruhu organismů včetně lidí, rostlin a hmyzu. Rostou velmi pomalu, dokonce i za ideálních podmínek s generačním časem dosahujícím u některých druhů až 9 hodin. Mají také velmi dlouhou lag-fázi, takže může trvat celý týden, než se na agarových plotnách objeví viditelné kolonie. Vzhledem k jejich redukovanému genomu a neschopnosti provádět základní funkce jsou mykoplazmata závislá na svém hostiteli pro většinu své nutrice.
Mnoho druhů mykoplazmat jsou komenzálové, žijící neškodně se svým hostitelem jako součást přirozené tělesné flóry a nemající škodlivé účinky. Ale když mykoplazmata působí jako patogeny, vyvolávají chronické, spíše lehčí infekce, pouze výjimečně mohou svého hostitele zabít. Jsou obvykle povrchovými parazity, ačkoliv několik druhů, podobně jako M. penetrans, jsou intracelulárními patogeny.
Patogeneze
Faktory adherence
Mykoplazmata jsou extracelulární patogeny, adherující k povrchu epitelových buněk. Adherentní proteiny jsou hlavními faktory virulence. Adherentní protein M. pneumoniae byl definován jako 168 kD protein a označen jako adhezin P1. Je lokalizován v bakteriální špičce a váže se ke zbytkům kyseliny sialové v membráně epitelových buněk (Obr. 2). Povaha adhezinů v ostatních species nebyla určena. Kolonizace respiračního traktu M. pneumoniae má za následek zastavení pohybu řasinek (cilií). Normální čistící mechanismus respiračního traktu nefunguje a dochází tak k jeho kontaminaci a vzniku suchého kašle.
Toxické metabolické produkty
Těsné spojení mykoplazmat s hostitelskou buňkou vytváří prostředí, ve kterém se akumulují oxytoxické produkty a poškozují hostitelské tkáně. Peroxid vodíku a superoxidové radikály, které jsou produkty metabolismu mykoplazmat, jsou odpovědné za patogenezi, neboť oxidují lipidy hostitelských tkání. Zjistilo se také, že mykoplazmata inhibují katalázu hostitelských buněk, čímž zvyšují koncentraci peroxidu vodíku a superoxidových radikálů.
Imunopatogeneze
Mykoplazmata aktivují makrofágy a stimulují tvorbu cytokinů a aktivaci lymfocytů (M. pneumoniae funguje jako superantigen). Tudíž lze předpokládat, že k patogenezi přispívají také hostitelské faktory. Experimentální důkazy na zvířatech tyto předpoklady podporují. Chirurgické odstranění thymu před infekcí M. pneumoniae brání rozvoji pneumonie a u zvířat s navrácenou funkcí thymu se pneumonie rozvíjí obnovenou rychlostí. Epidemiologická data u lidí nasvědčují tomu, že pro vznik klinických projevů onemocnění jsou zapotřebí opakované infekce, což opět poukazuje na roli hostitelských faktorů v patogenezi. Většina dětí je infikována ve věku 2-5 let, ale onemocnění jsou nejběžnější u dětí ve věku 5-15 let.
Patologie
Mykoplazmata bývají spojena s několika chronickými nemocemi, včetně únavového syndromu, fibromyalgického syndromu, syndromu Války v zálivu a revmatoidní artritidy. Je jednoznačná korelace mezi těmito chorobami a mykoplazmovými infekcemi, ačkoliv souvislost zůstává nejasná. U pacientů s chronickým únavovým a fibromyalgickým syndromem byla zjištěna Mycoplasma spp. u 62,9 %, resp. 50 % pacientů.(10) Bylo také zjištěno, že více než 50 % pacientů s revmatoidní artritidou mělo mykoplazmové infekce a 36 % z nich mělo mnohočetné mykoplazmové infekce způsobené různými druhy mykoplazmat. Ve studii nemocných se syndromem Války v zálivu mělo asi 50 % pacientů mykoplazmové infekce.(11) Tato skutečnost vedla k šíření pověsti, že šlo o první válku, ve které byly použity biologické zbraně, zejména zbraně s biologicky upravenými kmeny mykoplazmat.
Nejčastějšími příznaky asociovanými s mykoplazmovými infekcemi bývají intermitentní horečky včetně nočních potů, chronická únava, kožní zarudnutí, zvýšená kožní citlivost, bolesti kloubů a svalů, otoky se sníženou pohyblivostí kloubů, srdeční palpitace, bolesti a arytmie, žaludeční křeče a regurgitace, zhoršení zraku, dvojí vidění a další příznaky. Ačkoliv je jasné spojení mykoplazmové infekce s výše vyjmenovanými chorobami, není zcela zřejmé, která je prekursorem. Mykoplazmata mohou vyvolávat různé infekce nebo mohou být oportunním patogenem, který kolonizuje hostitele s oslabeným imunitním systémem a způsobí sekundární infekci.
Onemocnění vyvolaná M. pneumoniae
Epidemiologie
Pneumonie způsobená M. pneumoniae se objevuje po celém světě a není patrná žádná sezónní aktivita. Nicméně epidemie se objevují ve 4-8letých cyklech. Choroba se šíří úzkým kontaktem pomocí aerosolových kapének a je snadno přenosná v úzkých kolektivech (např. rodiny, školy, kasárna). Onemocnění se primárně vyskytuje u mladých lidí ve věkové kategorii 5-15 let.
Důležitost M. pneumoniae jako příčiny komunitně získané pneumonie se stala mnohem zřetelnější s rozvojem moderních technik pro průkaz tohoto patogenu. U dospělých představuje M. pneumoniae nejčastěji detekovaný atypický mikroorganismus.(12) Mezi komunitně získanými pneumoniemi se M. pneumoniae objevuje jako součást smíšené infekce v koinfekci se Streptococcus pneumoniae, Chlamydophila pneumoniae a legionelou.(13) S. pneumoniae s M. pneumoniae nebo C. pneumoniae se zdají být nejběžnější kombinací patogenů u smíšené pneumonie a těmto kombinacím by měla být věnována největší pozornost.(14, 15)
Klinické projevy
Nejběžnějším klinickým příznakem následujícím infekci M. pneumoniae je tracheobronchitida, která se vyskytuje u 70-80 % infekcí. Přibližně jedna třetina infikovaných osob má pneumonii, která je obvykle mírná, ale s dlouhým trváním. Pneumonie způsobené tímto mykoplazmatem byly uváděny jako „primární atypická pneumonie“ nebo „migrující pneumonie“, pro něž je charakteristický malý fyzikální nález a rozsáhlý rtg nález.
Inkubační doba po infekci je přibližně 2-3 týdny, během ní se postupně objevuje horečka, bolesti hlavy a neklid. Tyto příznaky mohou být doprovázeny přetrvávajícím neproduktivním dávivým kašlem. Respirační příznaky se objevují poněkud později a přetrvávají několik týdnů. Při rtg vyšetření u mykoplazmatické pneumonie se objevují známky pneumonie ještě před nástupem respiračních příznaků. Organismus je možno vykultivovat ze sputa už před objevením se příznaků a po celou dobu tohoto onemocnění. Ústup onemocnění je pomalý, ale nemoc je jen vzácně fatální. Onemocnění je nutno diferencovat od ostatních atypických pneumonií. Mívá sekundární mimoplicní systémové komplikace s neurologickými symptomy, postižením GIT, kloubů a disponuje k intravaskulární koagulaci.(1)
Imunitní odpověď hostitele
Komplex interakcí mezi mykoplazmaty a hostitelovým imunitním systémem zahrnuje mykoplazmaty indukované specifické i nespecifické imunitní reakce. Aktivace komplementu prostřednictvím alternativní cesty a fagocytujících buněk hrají roli v rezistenci k infekci. S postupem infekce hrají protilátky, zejména IgA, roli v její kontrole. Nejprve jsou produkovány protilátky IgM a později, v období rekonvalescence, IgG. Rozvoj přecitlivělosti opožděného typu je spojen se závažností onemocnění.
Laboratorní vyšetření
Diagnózu v iniciálním stadiu choroby je třeba stanovit na základě klinických příznaků, avšak pro sledování dalšího vývoje infekce jsou dostupná laboratorní vyšetření.
Mikroskopické vyšetřeníObvykle je nepoužitelné kvůli nepřítomnosti stěny u mykoplazmat, ale napomáhá vyloučení ostatních možných patogenů.
KultivaceSputum (obvykle nestačí) nebo výplach hrdla se musí zaslat do laboratoře ve speciálním transportním médiu. Trvá 2-3 týdny, než se získá pozitivní identifikace. Kultivace je nezbytná pro definitivní diagnózu.
Sérologie
a) Komplement fixační test. Má dobrou citlivost i specifitu, avšak titry nedosahují vrcholu dříve než 4-6 týdny po infekci. Čtyřnásobný vzestup titru ukazuje na prodělanou infekci. Vzhledem k tomu, že protilátky mohou perzistovat až 1 rok, nemusí přetrvávající vysoký titr indikovat probíhající infekci.
b) Chladové aglutininy. Asi 34-68 % pacientů s infekcí M. pneumoniae vytváří chladové aglutininy, protilátky, které aglutinují lidské erytrocyty při 4 °C, ale nikoliv při 37 °C. Antigen, proti kterému jsou vytvářeny protilátky, je antigen I. Tyto protilátky se zvyšují před komplement-fixačními protilátkami a také rychleji klesají. Chladové aglutininy nejsou specifické pro infekce M. pneumoniae a mohou se objevovat i při ostatních infekcích a dalších chorobách (např. infekční mononukleóze, chřipkových infekcích, nemoci chladových aglutininů, leukémii). Avšak, jsou-li přítomné u pacientů s klinickými známkami infekce M. pneumoniae, může se stanovit pravděpodobná diagnóza.
c) ELISA. Byl vyvinut nový ELISA test pro průkaz specifických IgM, který lze použít pro diagnostiku akutní infekce. Je citlivý a specifický, ale není zatím komerčně dostupný.
d) Přímý průkaz DNA M. pneumoniae PCR testy. V současné době jsou dostupné vysoce specifické a citlivé certifikované testy na bázi klasické PCR i real-time PCR, umožňující také kvantifikaci patogenu. Výsledek posledně jmenovanou metodou může být lékaři dostupný do 90 minut, nejpozději 2 hodin.
Léčba a prevenceJelikož mykoplazmata postrádají buněčnou stěnu, jsou neúčinná antibiotika penicilinové řady a cefalosporiny. Antibiotiky volby jsou tetracykliny (pouze pro dospělé), u kterých je nutno vzít v úvahu možnost asi 4-20% rezistence, a makrolidová antibiotika, resp. erytromycin. Prevence je problémem vzhledem k délce onemocnění, neboť je problematické tak dlouho izolovat pacienta, aby se nedostal do dalšího kontaktu. Zatím v současné době není dostupná žádná vakcína.
Onemocnění vyvolaná Mycoplasma hominis, M. genitalium a Ureaplasma urealyticum
Mykoplazmata a ureaplazmata často kolonizují genitourinární trakt dospělých osob, zejména jsou-li sexuálně aktivní, a v mnoha případech bývají příčinou chlamydia-negativních negonokokových uretritid.
Epidemiologie. Kolonizace M. hominis a U. urealyticum se může objevit během porodu, ale ve většině případů infekce vymizí. Pouze u malého počtu případů kolonizace přetrvává, a když se jednotlivci stávají sexuálně aktivními, její rychlost se zvyšuje. Asi 15 % je kolonizováno M. hominis a 45-75 % U. urealyticum. Nosiči bývají asymptomatičtí, ale organismy mohou být oportunními patogeny.
Klinické syndromy. M. hominis a M. genitalium bývají často spojena s pyelonefritidou, pánevní zánětlivou chorobou (pelvic inflammatory disease - PID) a poporodní horečkou. U. urealyticum a M. genitalium, někdy spolu s Chlamydia trachomatis, bývají spojena s negonokokovou uretritidou. U. urealyticum a M. hominis mohou být také příčinou pneumonie, bakteriémie a meningitidy u novorozenců. Ureaplazmata se mohou také podílet na infertilitě, poporodní endometritidě, chorioamnionitidě, spontánním abortu, porodu mrtvého plodu, předčasném porodu a perinatální morbiditě a mortalitě.
Laboratorní diagnostika. Laboratorní diagnóza je kultivační. V současné době narůstá význam přímého průkazu DNA patogenů technikami PCR a real-time PCR.
Léčba a prevence. Stejně jako u M. pneumoniae, vzhledem k chybění buněčné stěny, jsou neúčinná antibiotika penicilinové řady a cefalosporiny. Terapeutický přístup je u těchto mykoplazmat stejný jako v případě M. pneumoniae. Prostředky prevence jsou sexuální abstinence nebo správná bariérová ochrana za použití kondomu.
Onemocnění asociovaná s M. penetrans, M. fermentans
M. penetrans bylo poprvé identifikováno v r. 1991 v moči homosexuálních mužů infikovaných HIV, ale nikoliv u zdravých dobrovolníků, a také bylo zachyceno u pacientů s Kaposiho sarkomem. M. penetrans může být zjištěno v uretře, rektu a hrdle homosexuálních mužů.(16) M. fermentans kolonizuje sliznice zdravých osob, což komplikuje rozpoznávání jejich role v patogenezi.(17)
Od konce 80. let 20. stol. se v souvislosti s rozvojem AIDS věnuje zvýšená pozornost M. fermentans jako možnému mediátoru nebo kofaktoru infekce HIV. V každém případě se toto agens jeví jako oportunní patogen a za určitých okolností se vyskytuje i u osob HIV-negativních. M. fermentans bylo detekováno v urogenitálním a respiračním traktu, také v kostní dřeni ve spojení se systémovými onemocněními dospělých zahrnujícími zánětlivou artritidu a pneumonii.(18) M. fermentans nebylo detekováno kultivačně ani pomocí PCR u pacientů s uretritidou nebo cervicitidou, bylo však zjištěno v amniové tekutině, v choriových klcích placenty, což nasvědčuje možnosti transplacentárního přenosu a invaze do vyšších oblastí reprodukčního systému. M. fermentans bylo také zjištěno v krvi pacientů s chronickým únavovým a fibromyalgickým syndromem.(11)
Uvedené údaje pouze naznačují složitou problematiku nejmenších baktérií, jejichž postupné hlubší poznávání umožnil teprve rozvoj metod molekulární biologie a genetiky. S tím souvisí i určování jejich role a místa v klinických stavech, zahrnujících nejen akutní a chronické infekce respiračního a urogenitálního systému, ale i navazující složité komplikace s postižením ostatních orgánů. Hrají roli v autoimunitních procesech, kdy patrně při těsném kontaktu buněk parazita a hostitele je možná fúze membrán a výměna antigenů.
U nemocných byly nalezeny imunokomplexy, protilátky proti tkáním a dále chladové aglutininy, zvažované při vzniku intravaskulární koagulace. Důležité je rozpoznávání úlohy skupiny AIDS-asociovaných mykoplazmat u pacientů s infekcí HIV a onemocněním AIDS. Všechny tyto jejich vlastnosti přispívají k pověsti záhadných a záludných nejmenších baktérií s možným velkým negativním dopadem na zdravotní stav hostitele. Praktickým problémem je, že dosud není jejich role v diagnostice uvedených onemocnění dostatečně zvažována.
O autorovi: 1MUDr. Soňa Křemenová, 2, 3doc. MUDr. Jaromír Křemen, CSc.
1Dermatovenerologická klinika FNKV a 3. LF UK v Praze
2Univerzita Karlova v Praze, 1. LF UK, Ústav biochemie a experimentální onkologie
3Ústav biochemie a patobiochemie FNKV v Praze
email: kremeno@fnkv.cz
