Autor v přehledné práci popisuje fyziologické funkce vazopresinu a zabývá se především jeho indikacemi z pohledu intenzívní medicíny.
Summary
Kunstýř, J. The use of vasopressin and terlipressin in intensive medicine
Vasopressin is essential in osmoregulation and in body's water management, but also participates in the management of blood vessels tonus and thus helps to maintain circulatory stability. In clinical practice, vasopressin or its analog terlipressin, in addition to the traditional treatment of bleeding oesophagus varices, are also used for serious circulatory conditions such as cardiac arrest, septic shock, vasodilatory shock after extracorporeal circulation or haemorrhagic shock. In this overview article the author describes physiological functions of vasopressin and deals with its particular indications in terms of intensive medicine.
Úvod
Vazopresin (antidiuretický hormon, ADH), hormon syntetizovaný v hypotalamu a poté transportovaný do neurohypofýzy, má zásadní fyziologický význam v osmoregulaci a v hospodaření organismu s vodou. Podílí se také na řízení tonu cév a tím pomáhá udržet oběhovou stabilitu především v situacích, kdy ostatní mechanismy regulující tlak a perfúzi orgánů jsou z jakéhokoliv důvodu nefunkční. Má také další důležité fyziologické funkce. Vazopresin či jeho analoga terlipresin a desmopresin jsou tradičně používány v léčbě krvácení z jícnových varixů, centrálního diabetu insipidu nebo hepatorenálního selhání. Kromě těchto indikací je však vazopresin (Pitressin®, Parke Davies) od relativně nedávné doby podáván také při některých závažných oběhových stavech v anestézii a intenzívní medicíně. Stal se například v některých zemích součástí doporučení pro kardiopulmonární resuscitaci.
V České republice je dostupný pouze na zvláštní dovoz, což jej činí pro konkrétního pacienta, nacházejícího se v danou chvíli v kritickém stavu, téměř nepoužitelným. Volně k dispozici je u nás pouze jeho analog terlipresin (Remestyp®, Ferring-Léčiva), který je však pro svou odlišnou farmakokinetiku v těchto situacích méně vhodný. V práci jsou zmíněny fyziologické funkce vazopresinového systému a přehledně zpracovány jeho možné indikace v oblasti anestézie a intenzívní medicíny.
Historie
Jelikož se vazopresin nachází jako nonapeptid u obratlovců i bezobratlých, dá se předpokládat, že gen odpovídající za jeho syntézu byl ve výbavě živočichů ještě před rozdělením těchto dvou velkých skupin, tj. před více než 700 milióny let.
V roce 1895 poprvé pozorovali Oliver a Schafer vazopresorický efekt extraktu z podvěsku mozkového, který připisovali jeho zadnímu laloku, a o více než deset let později byl popsán také jeho antidiuretický účinek. V roce 1913 Fariny a von den Velden nezávisle na sobě úspěšně léčili pacienty s močovou úplavicí injekcemi neurohypofyzeálního extraktu. Vazokonstrikční účinky hormonu zadního laloku hypofýzy popsal v experimentu na konci dvacátých let minulého století také Krogh na plovacích blanách nohou žab a na uších psů. V padesátých letech pak, po izolaci a syntéze vazopresinu Turnerem a du Vigneaudem, bylo prokázáno, že se jedná o jednu látku s dvojím – antidiuretickým a vazopresorickým – účinkem.(1)
Syntéza vazopresinu, receptory
Vazopresin je nonapeptid s disulfidickým můstkem mezi dvěma molekulami cysteinu. Jelikož lidský hormon obsahuje aminokyselinu arginin, je také někdy nazýván arginin-vazopresin, pro odlišení od jeho analogů. Je syntetizován jako prohormon v magnocelulárních neuronech v nucleus paraventricularis a nucleus supraopticus hypotalamu, odkud je, spolu s transportním proteinem neurohypofyzinem, transportován supraoptiko-hypofyzeálním traktem do zakončení axonů magnocelulárních neuronů v pars nervosa zadního laloku hypofýzy. Tam je uložen ve vezikulách a uvolňuje se při zvýšené frekvenci akčních potenciálů stimulujících tyto neurony.(2) Asi 10–20 % může být takto pohotově vyplaveno do oběhu, ale dále, při přetrvávající stimulaci, pokračuje sekrece ve významně menším množství. To může vysvětlit dvoufázový charakter úrovně hladiny vazopresinu v septickém šoku, kdy zpočátku je výrazně vysoká a později klesá na neobvykle nízké hodnoty.
Při exogenním podání má rychlý nástup účinku, je metabolizován v játrech a ledvinách a z malé části se vylučuje do moči. Plazmatický poločas vazopresinu je cca 24 minut, proto k udržení jeho efektu je vhodné kontinuální intravenózní podávání, které současně činí léčbu touto vazoaktivní látkou lépe řiditelnou. Naproti tomu terlipresin (N3-triglycyl-8-lysin vazopresin) je proléčivo v organismu metabolizované na účinnou látku po odštěpení N3-triglycylového zbytku endoteliálními peptidázami. Má poločas delší než 6 hodin a proto se spíše podává v bolusových dávkách. Jeho efekty, včetně vedlejších, jsou však potom obtížněji kontrolovatelné.
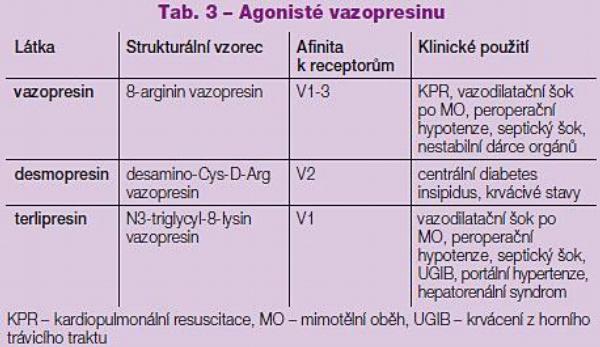
Byly identifikovány 3 typy vazopresinových receptorů: V1, V2 a V3 (Tab. 1). V1 receptory se nacházejí v mnoha tkáních, především na hladkých svalových buňkách cév a jejich stimulace vede k vazokonstrikci. V buňkách membrány distálního tubulu a sběrných kanálků ledvin se nacházejí V2 receptory, které regulují permeabilitu kanálků pro vodu. Vazopresin rovněž zvyšuje koncentraci moči jinými mechanismy včetně zvýšení dřeňového koncentračního gradientu a snížení krevního průtoku vnitřní vrstvou dřeně beze změn v průtoku kůrou. V3 receptory se převážně nacházejí v centrální nervové soustavě a jejich stimulace reguluje kortikotropní sekreci. Vazopresinové receptory mají strukturu heptahelikálních membránových proteinů vázaných se specifickým G proteinem, který zprostředkuje intracelulární přenos signálu.

Hladiny vazopresinu v plazmě
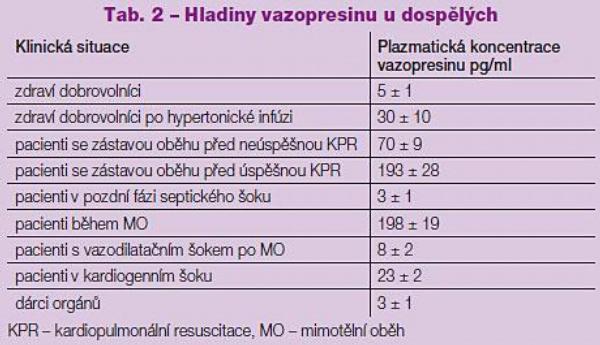
Plazmatická hladina vazopresinu se běžně pohybuje v rozmezí 0–20 pg/ml v závislosti na hydrataci a osmolaritě. U zdravého, normálně hydratovaného jedince je nalačno jeho hodnota 5 ± 1 pg/ml. Nedostatek vody zvýší hladinu vazopresinu na 10 pg/ml a infúzí hypertonického roztoku soli s nárůstem osmolarity na 304 ± 2 mosmol/l lze dosáhnout hodnoty 30 ± 10 pg/ml.(3) K mnohonásobnému zvýšení koncentrace hormonu v plazmě dochází při výrazné hypotenzi, hemoragickém šoku, při srdeční zástavě, časné fázi septického šoku a během mimotělního oběhu. Naopak, relativně nízké hladiny vazopresinu byly zjištěny v experimentálních i klinických studiích u vazodilatačního šoku po mimotělním oběhu, v pozdní fázi septického šoku a u hemodynamicky nestabilních dárců orgánů (Tab. 2).(4–7)
Takové situace lze hodnotit jako stavy „relativní vazopresinové deficience“, protože množství hormonu v plazmě neodpovídá závažnosti oběhového stavu, konkrétně hluboké hypotenzi, případně hypovolémii. Mechanismus tohoto deficitu není zcela objasněn, ale možným vysvětlením je buď vyčerpání zásob vazopresinu při protrahované stimulaci, nebo jeho nedostatečné, baroreflektoricky řízené uvolňování v důsledku dysfunkce autonomního nervového systému.
Vazopresin má především význam při kontrole osmolarity, kardiovaskulární stability a homeostázy. Zasahuje také do uvolňování kortikotropního hormonu a ovlivňuje paměť a učení. Řízení jeho uvolňování je komplexní a dá se rozdělit na stimulaci osmotickou (zvýšení osmolarity) a neosmotickou (hypotenze, hypovolémie, hormony + mediátory).
Farmakokinetika vazopresinu
Vazopresin cirkuluje v plazmě jako volný peptid a jeho distribuční prostor odpovídá přibližně množství extracelulární tekutiny (14 ml/kg). Je rychle distribuován extracelulárně a intravenózně podaný účinkuje během několika minut. Jeho plazmatický poločas je 24 minuty a metabolizován je ze dvou třetin v ledvinách a zbytek v játrech. Většina hormonu filtrovaného ledvinami je reabsorbována v tubulech. Clearence vazopresinu lineárně narůstá s rychlostí jeho infúze a je redukována při chronické renální insuficienci a jaterní cirhóze.
Osmotické stimuly uvolňující vazopresin a osmoregulace
Za normálních fyziologických podmínek je hlavní rolí vazopresinu regulace osmolarity a vodního hospodářství. Osmolarita je udržována v relativně úzkém fyziologickém rozmezí (285–290 mosmol/l) díky činnosti magnocelulárních neuronů uvolňujících vazopresin v hypotalamu. Tyto nervové buňky fungují jako centrální osmoreceptory reagující na zvýšenou osmolaritu extracelulární tekutiny ve svém okolí. Existují také periferní osmoreceptory v portálních žilách jater, které umožňují časnou detekci změn osmolarity, k nimž dochází po vstřebání potravy či tekutin. Cestou nervus vagus se odtud informace dostává centrálně až do hypotalamu.
Vazopresin uvolněný při zvýšení osmolarity stimuluje V2 receptory ve sběrných kanálcích ledvin, které zvýší svou propustnost pro vodu a umožní tak její návrat do cirkulace, a tím snížení osmolarity. Defekt tohoto systému vede k excesivním ztrátám vody a nazývá se úplavice močová (diabetes insipidus). Mutace V2 receptoru v ledvinách je periferním postižením a centrálním diabetem nazýváme poruchu uvolňování vazopresinu z hypotalamu. Příčina může být idiopatická či sekundární jako následek kraniotraumatu, ischémie či tumoru mozku, což vede k dysfunkci centrálních osmoreceptorů. Při léčbě tohoto centrálního postižení může být vazopresin nahrazen svým syntetickým, V2 selektivním analogem desmopresinem (desamino-Cys-D-Arg vazopresin – DDAVP) (Tab. 3). Ten není, na rozdíl od vazopresinu, natráven trypsinem a může být proto podán perorálně, i když nejčastější cestou aplikace je nosní sliznice. Individuální dávkování v této indikaci se pohybuje od 5 do 40 µg dvakrát denně. Antidiuretický efekt se dostavuje během 15 minut a přetrvává zhruba 8–12 hodin.(2)
Neosmotické stimuly uvolňující vazopresin, jeho úloha v kontrole kardiovaskulární stability
Nejsilnějšími neosmotickými stimuly pro uvolňování vazopresinu jsou hypotenze a pokles intravazální náplně, při nichž se hladina hormonu exponenciálně zvyšuje, aniž by se přitom narušila běžná osmoregulace. Aferentní impulzy z napěťových receptorů v levé síni, aortálním oblouku a karotickém sinu vedené vagem tonicky inhibují jeho sekreci a naopak, omezení těchto akčních potenciálů vede k jeho uvolnění do cirkulace. Objemové a tlakové impulzy ovlivňují uvolňování vazopresinu různým způsobem. Zatímco baroreceptory v síni signalizují změny v krevním objemu, receptory v aortě a karotických sinech reagují na pokles arteriálního tlaku.
Receptory v síních zasahují do kontroly krevního objemu hlavně přes uvolňování atriálního natriuretického peptidu (ANP), reninu a stimulací sympatiku. Proto pokles centrálního žilního tlaku způsobí především zvýšené vyplavování noradrenalinu a reninu, zatímco ke zvýšení hladiny vazopresinu dojde až po poklesu středního arteriálního tlaku. Naopak, objemová nálož a vzestup tlaku vedou k přechodnému útlumu vyplavování vazopresinu spíše stimulací síňových napěťových receptorů než arteriálních baroreceptorů. Přestože jak pokles tlaku, tak hypovolémie hrají svou roli v uvolňování vazopresinu, zdá se, že spíše jsou za jeho vyplavení do systémové cirkulace odpovědné kardiální receptory.(2) Kardiovaskulární stabilita je udržována díky vzájemné součinnosti tří hlavních vazopresorických systémů: sympatického, renin-angiotenzinového a vazopresinového.
Za normálních fyziologických okolností, dokud jsou hlavní dva systémy intaktní a funkční, se vazopresin na kontrole udržování cévního tonu a arteriálního tlaku významně nepodílí, ale jeho význam narůstá především při blokádě sympatiku či renin-angiotenzinového systému, například během kombinované celkové a epidurální anestézie u pacientů chronicky užívajících ACE-inhibitory, u nemocných s ortostatickou hypotenzí či s autonomní dysfunkcí. Za těchto okolností i malé změny hladiny vazopresinu pomáhají udržet dostatečný arteriální tlak zvýšením periferní vaskulární rezistence. Vazopresin způsobí významnou vazokonstrikci v kůži, kosterním svalstvu, tuku, štítné žláze a v pankreatu svým působením na V1 receptory.
Menší vazokonstrikční efekt má na mezenterické a také na koronární a mozkové cévy, kde má v nízkých dávkách dodatečný vazodilatační účinek díky uvolňování NO. Na druhou stranu, při intaktním neurohumorálním systému je efekt exogenně podaného vazopresinu utlumen a zvýšení jeho hladiny až na 300 pg/ml u zdravých dobrovolníků nemá vliv na arteriální tlak. A současně, jsou-li ostatní vazopresorické systémy intaktní, nevýznamné hemodynamické změny se na hladinách vazopresinu neprojeví.
Mezi další významné neosmotické stimulátory zvyšující hladinu vazopresinu a mající význam v medicíně kriticky nemocných patří histamin, acetylcholin, nikotin, prostaglandiny, angiotenzin II, dopamin a další katecholaminy. Z důležitých nehormonálních či nemediátorových stimulů můžeme jmenovat hyperkapnii a hypoxémii. Naopak opioidy, ?-aminomáselná kyselina, oxid dusnatý a ANP patří mezi inhibitory vyplavování vazopresinu.(1)
Kortikotropní sekrece a centrální regulační funkce vazopresinu
Kortikotropní sekrece je řízena především zpětnovazebně kortikotropin-uvolňujícím hormonem (CRH) jako odpověď na pokles hladiny kortizolu. Zdá se, že neurony v paraventrikulárním jádře hypotalamu, produkující CRH, obsahují také vazopresin a oba hormony fungují synergicky na liberaci kortikotropinu. Vazopresin zesiluje efekt CRH, což ukazuje na jeho zapojení do řady stresových odpovědí. Tyto reakce jsou zprostředkovány V3 receptory, které jsou bohatě distribuovány v centrálním nervovém systému.(8)
Efekt vazopresinu na další orgány a systémy
U pacientů s normální či mírně sníženou srdeční funkcí snižuje vazopresin srdeční výdej. Pravděpodobně je to reflexní reakce na zvýšení systémové vaskulární rezistence a ve vysokých dávkách pak následek zhoršení koronární perfúze. Na rozdíl od katecholaminů má vazopresin v některých orgánech vazodilatační účinek, který se projevuje převážně při nízkých dávkách. Jelikož není znám subtyp receptoru, odpovědný za tento efekt, předpokládá se, že jej způsobuje uvolňování NO z endotelu cév. Takto mediovaná vazodilatace byla pozorována v mozku, plicích, koronárním a mezenteriálním řečišti a v ledvinách, kde navíc má vazopresin menší konstrikční vliv na vas afferens glomerulu než katecholaminy. Při překročení doporučených dávek, nejčastěji při současné hypovolémii, se však výhodný vazodilatační účinek ztrácí a je potlačen vazokonstrikcí podmíněnou stimulací V1 receptorů.(1)
Vazopresin jako jiné stresové hormony usnadňuje hemokoagulaci. Zvyšuje hladinu faktorů VIII a von Willebrandova faktoru (vWf) a zrychluje agregaci trombocytů. V septickém šoku jsou tyto jeho účinky nevýhodné. Četné jeho další fyziologické vlivy však znemožňují jeho klinické použití v léčbě krvácivých stavů. K tomuto účelu je naopak používán selektivní V2 agonista desmopresin (Tab. 3), ačkoliv ani přesné místo, ani mechanismus tohoto jeho účinku nejsou známy. Je doporučen u pacientů s mírnou formou hemofilie A a u von Willebrandovy choroby. Intravenózní podání 0,3 µg/kg desmopresinu 3–5násobně zvýší hladinu faktoru VIII i vWf s vrcholem hladin během 30–60 minut. Jeho plazmatický poločas činí přibližně 8 hodin.(2)
Terapeutické použití vazopresinových agonistů v anestézii a intenzívní medicíně
Hypotenze během anestézie
Anestézie je obecně spojena se snížením tonu sympatiku a navíc, řada pacientů chronicky užívá ACE-inhibitory či antagonisty receptorů angiotenzinu II. Riziku závažné hypotenze jsou, mimo jiných, vystaveni také nemocní s kombinovanou celkovou a hrudní epidurální anestézií. Rozsáhlá centrální axiální blokáda vede k arteriální vazodilataci a sníží tlak. Navíc, sympatická blokáda zhorší baroreceptorovou kompenzaci a přeruší inervaci nadledvin, a tak sníží hormonální odpověď včetně uvolnění reninu, zatímco hladina vazopresinu při hypotenzi stoupne. Dojde-li, například při chronické léčbě ACE-inhibitory, k blokádě druhého ze tří systémů kontrolujících arteriální tlak, může se v průběhu anestézie rozvinout hypotenze refrakterní na opakované bolusy noradrenalinu.
Za takových okolností je indikováno podání V1 agonisty terlipresinu v bolusové dávce 1 mg, která dlouhodobě zvýší arteriální tlak do cca 1 minuty.(9) I když nebyly referovány významné vedlejší negativní účinky tohoto postupu, byla publikována 1 kazuistika popisující myokardiální ischémii jako následek těžké hypertenze, ke které došlo po podání terlipresinu indikovaného při refrakterní hypotenzi u nemocného s generalizovanou aterosklerózou.(10) Vazopresin může být účinný i při hypotenzi, následující po exstirpaci feochromocytomu, a to u pacientů, u kterých jsou z důvodu chronické adrenergní blokády katecholaminy nedostatečně účinné.
Hemoragický šok
V případě protrahovaného hemoragického šoku s rozvinutou acidózou a vazodilatací může být odpověď organismu na adekvátní volumoterapii a noradrenalin nedostatečná. Experimentální i klinická data ukazují příznivé účinky vazopresinu, podaného jako aditivum v takovéto oběhově dramatické situaci.(11) Nicméně, čas podání i samotná dávka se podle jednotlivých autorů podstatně liší od 40 j jednorázově po 0,04 j/min kontinuálně a v této oblasti bude vhodný další výzkum.
Vazodilatační šok během či po mimotělním oběhu
Během mimotělního oběhu je běžné výrazné zvýšení hladiny vazopresinu až k hodnotám 200 pg/ml. Podle některých autorů se však až u 8 % pacientů po operaci s použitím kardiopulmonárního bypassu rozvíjí vazodilatační šok, který je charakterizovaný normálním či zvýšeným srdečním výdejem a nízkou periferní vaskulární rezistencí.(12) Zmíněný stav může být součástí systémové zánětlivé odpovědi organismu na stresovou situaci, ale u těchto nemocných byla také zjištěna nízká hladina vazopresinu (Tab. 2). Proto byla vyslovena hypotéza, že se jedná o již zmíněnou relativní vazopresinovou deficienci. Ohroženi jsou především pacienti s nízkou ejekční frakcí levé komory chronicky léčení ACE-inhibitory. Infúze vazopresinu (0,1 j/min) suplementuje chybějící hormon a umožní snížit dávku či zcela vysadit současně podávaný noradrenalin. Obdobně spolehlivě v těchto případech funguje, podle zkušeností autora,(13) také kontinuálně podávaný terlipresin (0,08 mg/h).
Dárci orgánů
Podobně účinný se ukázal být vazopresin také u hemodynamicky nestabilních dárců orgánů. Jako následek kraniotraumatu, krvácení či tumoru se u potenciálních dárců orgánů někdy rozvíjí sekundární diabetes insipidus. Excesivní polyurie se v takových případech snižuje podáváním selektivního V2 agonisty desmopresinu, ale prokázalo se, že jeho prokoagulační efekt může způsobit zhoršenou funkci darovaných orgánů. Proto také bylo v těchto případech navrženo používat vazopresin.(14)
Kardiopulmonální resuscitace
Na základě metaanalýzy 5 randomizovaných studií(15) i dalších prací American Heart Association ve svých doporučeních pro kardiopulmonární resuscitaci z roku 2005 uvádějí bolusovou dávku vazopresinu 40 j jako alternativu k první či druhé dávce adrenalinu podávané v průběhu léčby komorové fibrilace/tachykardie.(16) Zmíněné práce neprokázaly statisticky významný rozdíl mezi vazopresinem (40 j bolus) a adrenalinem (1 mg opakovaně) co do návratu spontánní cirkulace (ROSC), 24hodinového přežití či propuštění z nemocnice. V uvedených doporučeních je uvedeno (bez navržené dávky) jako potenciálně výhodné použití vazopresinu i pro další stavy se závažnou hypotenzí, jakými jsou septický či anafylaktický šok. Také European Resuscitation Council doporučil (třída IIb) vazopresin v dávce 40 j jako úvodní lék a alternativu k 1 mg adrenalinu při léčbě elektrošok-rezistentní komorové fibrilace u dospělých.(17) Na druhou stranu, neexistují dostatečná data pro podobná doporučení u kardiopulmonální resuscitace dětí.
Portální žilní hypertenze
Terlipresin a o něco méně i vazopresin snižují svým účinkem na V1 receptory krevní průtok portálním řečištěm, a tím také tlak ve všech jeho částech, včetně jícnových varixů. Proto je také terlipresin, v dávce 1 mg nitrožilně po 4 hodinách, používán k léčbě jejich krvácení u pacientů s portální hypertenzí. Významně zmírní hyperdynamickou cirkulaci u nemocných s jaterní cirhózou a má i příznivé účinky u pacientů s rozvinutým hepatorenálním syndromem (HRS), u kterých je v kombinaci s infúzemi koloidních roztoků velmi slibným lékem.(18) Podáním terlipresinu je u těchto pacientů korigována splanchnická vazodilatace v kapacitním i arteriálním řečišti, způsobující hypervolémii splanchnickou a hypovolémii systémovou. Nasazením této léčby dojde k normalizaci distribuce intravazální náplně s následným zlepšením perfúze orgánů včetně jater a ledvin. Také díky většímu účinku terlipresinu na vas efferens je výsledkem léčby zvýšení clearence kreatininu, zvýšení glomerulární filtrace, stimulace natriurézy a exkrece moči, což vše jsou faktory příznivě ovlivňující přežívání nemocných s HRS.
Septický šok
Septický šok je definován jako závažná hypotenze (pod 90 mmHg) přetrvávající navzdory adekvátní volumoterapii a vazopresorické podpoře noradrenalinem u pacienta se sepsí. Na úrovni orgánů má septický pacient poškozenou autoregulaci a krevní průtok lineárně závisí na perfúzním tlaku. Mikrocirkulace je dysfunkční a dochází k maldistribuci krve. Patologická cévní dilatace je způsobena 3 mechanismy: zvýšenou tvorbou NO, otevřením K+ senzitivních ATP kanálů a nízkou hladinou vazopresinu.(19) A je to právě přítomnost tohoto hormonu v dostatečném množství, co blokuje první dvě zmíněné příčiny patologické vazodilatace. Vazopresin, na rozdíl od katecholaminů účinkujících na ?- a ß-receptory, blokuje K+ senzitivní ATP kanály v hladkých svalových buňkách cévní stěny.
Navíc inhibuje interleukin 1-ß, který je uvolňován při traumatu či infekci, a stimuluje endoteliální produkci vazodilatačně působícího NO. Hlavní mechanismus jeho vazopresorického účinku spočívá v mobilizaci intracelulárního kalcia z endoplazmatického retikula stimulací V1 receptorů. Nízká hladina vazopresinu byla v septickém šoku opakovaně prokázána(5) a bylo též zjištěno, že je neadekvátně nízká v porovnání s pacienty, kteří se například nacházejí v kardiogenním šoku. Tedy v obdobně nepříznivém stavu cirkulace, který je však způsoben selháváním srdce jako pumpy a nikoliv vazodilatací. Hladina vazopresinu má v průběhu sepse dvoufázový průběh. Na počátku je vysoká a při nástupu šoku klesá k neobvykle nízkým hodnotám.
To odpovídá způsobu, jakým je hormon uvolňován ze zásob v zakončeních axonů magnocelulárních neuronů v pars nervosa zadního laloku hypofýzy, kde je ve vezikulách pohotově k dispozici pouze 10–20 % jeho celkového množství. Exogenní substituce vazopresinu byla s úspěchem použita v řadě studií a infúze 0,01–0,04 j/min nejen zvýšila jeho plazmatickou hladinu, ale především v průběhu několika minut přispěla k vzestupu systémové vaskulární rezistence a arteriálního tlaku. Zároveň bylo možné významně snížit dávku noradrenalinu, protože vazopresin v nízkých dávkách má synergický účinek. Odrazem zlepšené perfúze orgánů pak byla zvýšená diuréza a glomerulární filtrace. U takto nízkých dávek nebyl pozorován vliv na plicní vaskulární rezistenci, tlak v plicnici či vnitřní prostředí.
Podle některých autorů je v. s. bezpečná dávka do 0,06 j/min a až při dávkách nad 0,1 j/min hrozí renální a mezenterická ischémie, pokles srdečního výdeje a dodávky kyslíku tkáním. Pozorován byl také pokles trombocytů. Projevem zhoršené orgánové perfúze je pak elevace jaterních enzymů, bilirubinu i vzestup renálních parametrů. Léčba může být zahájena u pacienta s dostatečnými plnícími tlaky, s normálním nebo zvýšeným srdečním výdejem, bez desaturací v centrální či smíšené žilní krvi a případně s nízkou systémovou vaskulární rezistencí prokázanou nejčastěji pomocí Swan-Ganz katétru. Mezi kritéria efektivnosti terapie patří obnova diurézy, zvýšení arteriálního tlaku, pokles hladiny laktátu a na druhou stranu absence známek kožní vazokonstrikce a setrvalá nebo zlepšená saturace centrální či smíšené žilní krve.
Alternativou, především v zemích, kde není vazopresin registrován, může být podání bolusové dávky 1–2 mg terlipresinu, která zvýší střední arteriální tlak na přibližně 5 hodin bez závažných vedlejších účinků. Někteří autoři používají současně kontinuální infúzi. Nicméně, terlipresin jako selektivní V1 agonista je silný intestinální vazokonstriktor a existují důkazy o zhoršené střevní perfúzi v průběhu jeho podávání u septických pacientů. Pracoviště autora má zkušenosti s kontinuální infúzí terlipresinu bez iniciálního bolusu v celkové dávce, která je nižší než obvykle podávaná u krvácení z jícnových varixů.(13) Na rozdíl od dobrých výsledků u postkardiotomického vazodilatačního šoku nevedla tato aditivní vazokonstriční léčba u pacientů se septickým šokem k normalizaci arteriálního tlaku, zlepšení perfúze orgánů a snížení dávek noradrenalinu.
Nejpravděpodobněji se na našem neúspěchu nejvíce podílelo příliš pozdní nasazení terlipresinu – již ve fázi ireverzibilní vazoparalýzy. V současné době probíhají další práce s terlipresinem porovnávající právě jeho různé kontinuální dávky s noradrenalinem případně s vazopresinem. Přes rozšířenou klinickou aplikaci vazopresinu pouze dvě menší randomizované studie dosud zhodnotily jeho použití u pacientů v septickém šoku. Ani jedna z nich však nebyla cílena na mortalitu či bezpečnost. Naproti tomu byla nedávno publikována jedna z nejrozsáhlejších studií na dané téma, která neprokázala, na souboru bezmála 800 pacientů v septickém šoku výhodu nízkodávkovaného vazopresinu (do 0,03 j/min) nad noradrenalinem.
Respektive, v této velmi dobře připravené práci nebyl zaznamenán signifikantní rozdíl ve 28 a 90denní mortalitě mezi oběma skupinami. Nicméně v podskupině nemocných s méně závažným septickým šokem (definovaným dávkou noradrenalinu nepřekračující 15 µg/min) byla prokázána signifikantně nižší mortalita u pacientů léčených vazopresinem. Také nebyly zaznamenány významné rozdíly ve výskytu závažných vedlejších účinků vazokonstrikční léčby.(5) Další studie by se jistě měly soustředit na sledování správného načasování léčby a případné limity dávek. Podle posledních mezinárodních doporučení pro léčbu sepse z r. 2008 (http://www.survivingsepsis.org/) by vazopresin neměl být v septickém šoku použit jako iniciální vazopresor a může být přidán k norepinefrinu v dávce 0,03 j/min. Vyšší dávky jsou spojené s rizikem kardiální, splanchnické a akrální ischémie a měly by být rezervovány pouze pro případy, v kterých ostatní vazopresorická podpora selhává. Pro jeho indikace u dětských septických pacientů neexistují přesvědčivé důkazy.(20)
Vedlejší účinky vazopresinu použitého v šokových stavech
V řadě indikací byly popsány četné vedlejší nežádoucí, především kardiovaskulární, účinky léčby vazopresinem, zahrnující vedle závažné hypertenze i myokardiální ischémii či maligní komorové arytmie. Vedle anafylaktických reakcí, bronchospazmu a kožních projevů jsou dalšími možnými riziky jeho podávání trombóza, ischémie gastrointestinálního traktu vedoucí v některých případech až k ischémii střeva a akrální vazokonstrikce s kožní gangrénou. Nicméně, většina uvedených komplikací se nevyskytla v souvislosti s podáváním vazopresinu pacientům v šokovém stavu, i když i u nich byla popsána zhoršená regionální perfúze. Důvodem může být relativně malý počet pacientů zahrnutých ve studiích a také jednoduše fakt, že se jednalo vždy o nemocné s deplecí endogenního vazopresinu. Substituční dávky užívané při závažné hypotenzi jsou navíc významně nižší než podávané například při krvácení z jícnových varixů.
Podle zkušeností autora je však někdy obtížné, především u nemocných zemřelých v septickém šoku pod obrazem multiorgánového selhání, spolehlivě odlišit, zda terminální selhávání orgánů je projevem neodvratně se blížící smrti, nebo může být důsledkem aditivní vazopresorické léčby, použité jako ultimum refugium. Pro klinickou praxi proto můžeme jen doporučit včasné zahájení této podpůrné terapie. Dojde-li poměrně krátce po jejím začátku ke klinickým či laboratorním projevům regionální hypoperfúze, je nutné dávku snížit či léčbu zcela zastavit. Z tohoto hlediska se jeví volba terlipresinu, který má dlouhodobý účinek, avšak je jediným dostupným prostředkem tohoto typu na našem trhu, jako ne příliš bezpečná.
Závěr
Fyziologické funkce přirozeného hormonu vazopresinu spočívají především v kontrole osmolarity a vodního hospodářství. Má však také svou roli v řízení tonu cév a jeho nedostatečná hladina se významně podílí na rozvoji refrakterních šokových stavů spojených se sepsí, hemoragií a mimotělním oběhem. Jeho funkce při kontrole udržování arteriálního tlaku se zvýrazňuje ve chvílích, kdy jsou ostatní systémy blokované, nefunkční či k udržení tlaku nestačí – například při anestézii a zástavě oběhu. Nízké dávky vazopresinu nebo terlipresinu mohou ve zmíněných situacích účinkem synergickým s noradrenalinem přispět k normalizaci cévního tonu a obnovení perfúze vitálně důležitých orgánů. Pro četné možné nežádoucí vedlejší účinky léčby vasopresinem či jeho analogem terlipresinem patří tyto vazoaktivní léky pouze do rukou zkušených anesteziologů – intenzivistů. Právě z těchto bezpečnostních důvodů by byla dosažitelnost krátkodobě působícího vazopresinu na našem trhu odborníky z praxe vítána.
O autorovi: MUDr. Jan Kunstýř, Univerzita Karlova v Praze, 1. lékařská fakulta a Všeobecná fakultní nemocnice, Klinika anestezie, resuscitace a intenzivní medicíny
e-mail: Jan. Kunstyr@vfn.cz











