Souhrn
Tekutina získaná bronchoalveolární laváží je vyšetřena cytologicky a mikrobiologicky. Zvláště při použití rychlých detekčních metod v rámci diagnostiky některých infekčních onemocnění plic může v korelaci s klinickým obrazem a zobrazovacími metodami posunout léčebnou strategii z empirické k preemptivní.
Summary
Tomíšková, M., Skřičková, J. Bronchoalveolar lavage – opportunities and risks of implementation, interpretation of some results
Bronchoalveolar lavage is an examination providing in immunocompromised patients within the fibrobronchoscope of differential diagnostics for pulmonary involvement of unknown origin. It better reflects pathological processes taking place at the peripheral airways and alveoli than sputum or bronchial lavage. It is a considerate method with minimal complications. The fluid obtained through bronchoalveolar lavage is examined cytologically and microbiologically. This method may shift an empirical treatment strategy to a preemptive one especially when rapid detection methods are used in correlation with clinical and imaging methods within the scope of diagnostics of certain pulmonary infectious diseases.
Bronchoalveolární laváž je vyšetření, které má zásadní význam v diagnostice plicního postižení u imunokompromitovaných nemocplicní ných. Je to relativně nenáročná a v rukou zkušeného bronchologa bezpečná metoda s možností jejího zopakování. Stanovení etiologie plicního postižení a včasné zahájení kauzální léčby může vést k záchraně života u těchto často kriticky nemocných.(1)
Definice
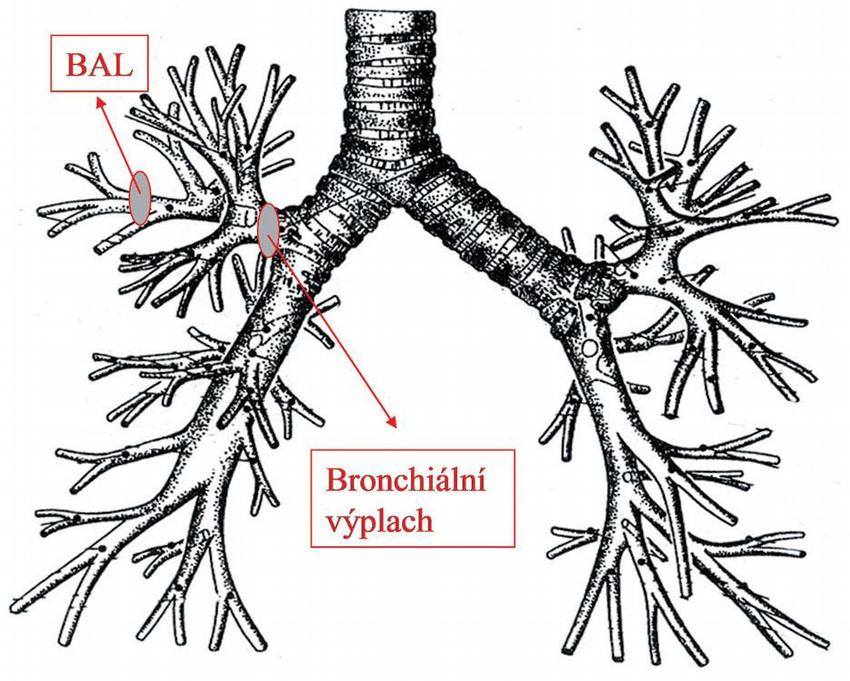
Bronchoalveolární laváž (BAL) je metoda, při které je instilován fyziologický roztok do dýchacích cest v celkovém množství 100–200 ml s cílem získat zpětnou aspirací tekutinu obsahující buněčné i nebuněčné složky z periferních dýchacích cest a alveolů. Tím se liší od bronchiálního výplachu, při kterém je prováděna zpětná aspirace malého množství tekutiny (20 ml) instilované do velkých dýchacích cest, obsahující buněčné složky z povrchu sliznice (odloupané dlaždicové a cylindrické epitelie, leukocyty, erytrocyty, baktérie atd.)(3, 6) Na Obr. je zobrazen rozdíl v lokalizaci provedení bronchoalveolární laváže a bronchiálního výplachu.
Indikace a kontraindikace bronchoalveolární laváže u imunokompromitovaných nemocných
Hlavní indikací provedení BAL je podezření na: * plicní infekce, * neinfekční zánětlivé procesy plicní (poradiační, polékové postižení plic, koincidence s jinými difúzními parenchymovými chorobami), * nádorové postižení plic při hematoonkologickém onemocnění, * duplicitní nádorové onemocnění plic.
Kontrolní BAL může sloužit i ke zhodnocení efektu léčby. Provedení bronchoalveolární laváže by mělo být zvažováno tam, kde se u imunokompromitovaného nemocného objeví nové celkové a nebo plicní symptomy, jako jsou kašel, obtíže s expektorací, dušnost, bolest na hrudi, teploty, hypoxémie a příznaky sepse. Také patologický poslechový nález na hrudníku a patologický nález na skiagramu hrudníku nebo HRCT (high resolution computed tomography) plic je indikací k provedení BAL. Může být prováděna v rámci diferenciální diagnostiky plicního postižení, kde empiricky zahájená léčba nevede ke zlepšení stavu nemocného.
Vyšetření je kontraindikováno tam, kde výsledek vyšetření nepovede ke změně léčebného postupu nebo není naděje, že zvrátí fatální průběh základního onemocnění. Nelze-li výkon provést v celkové anestézii, pak je BAL kontraindikována u nemocných, při bolestivých afekcích v dutině ústní, zmatenosti nemocného. Další kontraindikací provedení BAL pro riziko krvácení jsou přetrvávající spontánní krvácivé projevy přes komplexní hematologickou přípravu.
Samotný nízký počet trombocytů či patologické hodnoty koagulačních vyšetření nejsou kontraindikací provedení BAL. Vyšetření lze provádět i při léčebných dávkách antikoagulační léčby, pokud nejsou známky předávkování. Je nutné zvážit přínos vyšetření u nemocných v kritickém stavu (např. septický stav), v urémii, s čerstvým infarktem myokardu, závažnou arytmií a u kardiopulmonálně nestabilních nemocných. Kontraindikované je také toto vyšetření při přetrvávající hypoxémii pod 6 kPa i přes inhalaci kyslíku.(1, 2, 3, 6)
Příprava nemocného a způsob provedení
Bronchoalveolární laváž provádíme flexibilním bronchoskopem pouze po lokální anestézii nebo v kombinaci s analgosedací, eventuálně v celkové anestézii. U nemocných ve stabilizovaném klinickém stavu lze vyšetření provádět ambulantně na bronchoskopickém pracovišti, v případě vážného klinického stavu, zvláště u hypoxemických nemocných, na lůžku jednotky intenzívní péče nebo anesteziologicko-resuscitačním oddělení. U spolupracujících nemocných příprava spočívá v preventivním podání atropinu a antitusika před vyšetřením. Vyšetření se provádí u lačného nemocného po lokální anestézii horní části dýchacích cest aplikací Xylocainu ve spreji a 1% roztoku Mesocainu, poté je většinou přes dutinu ústní zaveden fibrobronchoskop.(1, 3) Po orientačním prohlédnutí dýchacích cest provádíme bronchoalveolární laváž, po té můžeme pokračovat v dalším vyšetřování dýchacích cest. V průběhu vyšetření se nedotýkáme špičkou bronchoskopu stěn bronchů, abychom nedráždili nemocného ke kašli a nekontaminovali bronchoskop materiálem z velkých dýchacích cest. Ze stejných důvodů se snažíme neaplikovat žádné léčebné přípravky do dýchacích cest, ani neodsávat nadměrný sekret v dýchacích cestách.
BAL se provádí z místa maximálního postižení plicního parenchymu, v případě difúzního plicního postižení je nejsnazší provedení laváže ze středního bronchu. Fibrobronchoskop se zavádí co nejdistálněji na úroveň segmentálního až subsegmentálního bronchu tak, aby byl vzduchotěsně zaklíněn o stěny bronchu a opticky bylo patrno další bronchiální větvení. Laváž se provádí aplikací fyziologického roztoku (FR) ohřátého na 37 °C injekční stříkačkou se spojovací hadičkou pracovním kanálem fibrobronchoskopu. Před zahájením aplikace nemocného vyzveme, aby se nadechl a zadržel dech. Pokud nemocný dobře spolupracuje a je při vyšetření klidný, je doporučováno, aby po instalaci roztoku před zpětnou aspirací provedl jeden až dva klidné vdechy, FR je zapotřebí vstřikovat po objemech 20–50 ml rychlostí přibližně 5 ml za sekundu, aby nedocházelo ke dráždění nemocného. Každá instilovaná část (porce) je většinou bezprostředně nebo s malou prodlevou aspirována zpět. Po ukončení BAL vyzveme nemocného, aby několikrát lehce zakašlal a tím umožnil snadnější odsátí zbytku lavážní tekutiny z dýchacích cest.
Tam, kde jsou patrné zánětlivé změny a vazká sekrece, je vhodné po aplikaci mukolytik provést toaletu bronchiálního stromu. Množství FR použité k BAL se řídí především návratností a počtem požadovaných vyšetření bronchoalveolární tekutiny (BAT). Při provádění laváže monitorujeme u každého nemocného saturaci periferní krve kyslíkem a tepovou frekvenci transkutánním oxymetrem.(1, 2, 3) U nemocných v závažném klinickém stavu je vyšetření prováděno za monitorace všech vitálních funkcí, v případě hypoxémie nemocný inhaluje kyslík nosními brýlemi. Za těchto okolností je zajistit možnost intubace a umělé plicní ventilace. Vyšetření v analgosedaci se provádí za dohledu a péče anesteziologa, neboť kvalita sedace je pro hladký průběh vyšetření velmi důležitá (paradoxní zhoršení spolupráce, nadměrný útlum nemocného).
Nejzávažnější komplikací bronchoalveolární laváže je vazovagální reakce s bradykardií až zástavou srdeční akce a dechu. Dalšími závažnými komplikacemi jsou laryngospazmus a bronchospazmus, prohloubení respirační insufience s nutností intubace a umělé plicní ventilace. Zimnice, třesavka a vzestup teploty se objevují po laváži zvláště u nemocných s plicní infekcí. Závažná může být i maligní arytmie, hypertenzní krize a alergická reakce na lokální anestetikum. Nemocný nesmí nejméně 2 hodiny po vyšetření pít a jíst, aby nedošlo k aspiraci potravy nebo tekutiny. Po ukončení vyšetření je nemocný sledován buď na stacionáři, nebo lůžku akutní péče.
Zpracování a transport vzorků bronchoalveolární tekutiny
Materiál získaný zpětným nasáváním tekutiny z dýchacích cest se shromáždí ve sterilní kádince a opatrně se promíchá, poté se rozdělí do jednotlivých nádob k požadovaným vyšetřením. První porce se odesílá zvlášť na mikrobiologické vyšetření a hodnotí se také zvlášť, protože se předpokládá kontaminace sekretem z velkých dýchacích cest. Pokud se bronchoalveolární tekutina odesílá na bakteriologické vyšetření, je výhodné používat pufrovaný FR (méně kyselý, protože v něm baktérie déle přežívají). Transport do laboratoří by měl být uskutečněn neprodleně po provedení laváže. Pokud je materiál zpracován do 1 hodiny, nemusí být transportován na ledu.(1, 2, 3)
Vyšetření a interpretace výsledků
Bronchoalveolární tekutina je vyšetřena cytologicky a mikrobiologicky. K cytologickému vyšetření je BAT nejdříve zpracována na cytocentrifuze. Pokud nejsou pracoviště pro toto zpracování vybavena, lze vyšetřovat buněčný sediment po sedimentaci v cytosedimentační komůrce, případně je možno použít běžnou centrifugu. Velmi užitečné pro kvalitu hodnoceného vzorku je vyhodnocení celkového počtu buněk, které se počítá v hemocytometru nebo obyčejné Bürkerově komůrce. Při hodnocení buněčného rozpočtu (diferenciálního rozpočtu) je doporučováno prohlédnutí nejlépe 600, minimálně 300 buněk. Jednotlivé zastoupení buněčných složek podává informaci o možné etiologii plicního postižení. U nemocných se závažnou neutropenií nebo lymfopenií však vyšetření diferenciálního rozpočtu může být zkreslené. Při cytologickém vyšetření můžeme zachytit přítomnost nádorových buněk, plísňových vláken a spor, pneumocyst, přítomnost acidorezistentních tyček, virových inkluzí. K tomu jsou nutná speciální barvení. V případě podezření na infekční etiologii plicního postižení vyšetřujeme bronchoalveolární tekutinu nejen mikroskopicky a kultivačně, ale vzhledem k nutnosti rychlé diagnostiky u imunokompromitovaných nemocných používáme i moderní sérologické a molekulárněbiologické metody (imunofluorescence, PCR).(3, 6)
Úskalí a nejistoty při hodnocení vyšetření BAT
Bronchoalveolární tekutina je materiál, který by měl na rozdíl od sputa nebo bronchiálního výplachu lépe odrážet procesy probíhající v periferních dýchacích cestách a alveolech. Úskalím v inspolupracujících terpretaci výsledků cytologických a mikrobiologických vyšetření je skutečnost, že postup při BAL není přesně standardizován.(5, 6) Není také jasné kritérium pro kvalitu provedení bronchoalveolární laváže, a tím získané bronchoalveolární tekutiny. Pokusy o stanovení určitých biochemických markerů (albumin, urea) nebo cytologických parametrů v BAT, které by jednoznačně stanovily, že se jedná o vzorek vhodný k dalšímu vyšetření a jednoznačné interpretaci, zatím selhaly. Důvodem je variabilní podíl alveolární tekutiny z navrácené celkové tekutiny (naředění tekutiny, možné „prosakování tekutiny“ s různým obsahem látek z krve) a tedy nelze zatím dosáhnout standardizace v kvantifikaci. BAT je primárně nesterilní materiál. Při provádění BAL může dojít ke kontaminaci tekutiny z vnějšího prostředí i zavlečením mikrobů z horních dýchacích a polykacích cest.
Ke kontaminaci mikroby může dojít i během laboratorního zpracování materiálu, což může způsobit falešnou pozitivitu výsledků, zvláště při využívání citlivých detekčních metod. Nikoliv posledním problémem je odlišení kolonizace baktérií, plísní a dalších mikroorganismů od skutečného původce plicní infekce.(1, 4, 5, 6) U imunokompromitovaných nemocných je doporučováno považovat za signifikantní pro infekci koncentraci baktérií více než 103 CFU/ml BAT. Podobná kvantifikace u jiných infekcí (např. houbových) však dosud není jednoznačně stanovena.(1, 2) Přesto lze s určitou přesností zhodnotit kvalitu provedené BAL, a tak s určitou rozvahou přistupovat k získaným výsledkům vyšetření BAT.
Za nekvalitní materiál považujeme tekutinu pokud: * nemocný špatně spolupracuje, při vyšetření kašle, * bylo zpět získáno méně než 50 % z celkového množství podané tekutiny, * vzorek obsahuje významnou příměs krve či hnisu, * vzorek má vzhled čistého fyziologického roztoku (pouze proplachování bronchoskopu), * je vzorek výrazně napěněný, což je způsobeno špatným zaklíněním fibrobronchoskopu.
I mikroskopické vyšetření BAT může být pomocné při hodnocení kvality BAT.
Neadekvátní vzorek je charakteristický tím, že obsahuje: * méně než celkově 2 milióny buněk a méně než 10 alveolárních makrofágů v 1 zorném poli, * nadměrné množství dlaždicových a cylindrických epitelií, * nadměrné množství degenerativně změněných polymorfonukleárních buněk, * převažující počet polymorfonukleárních buněk nad počtem alveolárních makrofágů.
Diagnostický význam bronchoalveolární laváže u imunokompromitovaných nemocných
I přes výše uvedená úskalí je význam bronchoalveolární laváže jako metody v diagnostice plicního postižení u imunokompromitovaných nemocných nesporný.
* U infekčních plicních chorob má jednoznačný diagnostický význam izolace Mycobacterium tuberculosis, Strongyloides, Toxoplasma gondii, Pneumocystis jiroveci, legionely, respiračního syncytiálního viru, viru influenzy z BAT.
* Přínosem pro stanovení diagnózy a léčby má izolace Herpes simplex viru, cytomegaloviru, kryptokoků, kvasinek, aspergilů, atypických mykobaktérií a mykoplazmat z BAT.
Zvláště při použití citlivých detekčních metod se zaměřením na průkaz antigenu např. metodou PCR musí být diagnostika těchto infekcí v korelaci s klinickým obrazem a zobrazovacími metodami.
* Jednoznačný diagnostický význam má cytologické vyšetření u neinfekčních plicních onemocnění, jako jsou alveolární proteinóza, eozinofilní granulom a zhoubné nádory.
* Ke stanovení diagnózy takových onemocnění, jako jsou alveolární hemoragie, eozinofilní pneumonie, berylióza, hypersenzitivní pneumonitidy, azbestóza, sarkoidóza, je významným přínosem, ale musí být v korelaci s dalšími vyšetřeními.
* Experimentální význam spíše v rámci diferenciální diagnostiky má vyšetření BAT u nemocí, jako jsou ARDS, chování tkáně po transplantaci plic, plicní projevy reakce štěpu proti hostiteli (GVHD).
Závěr
Bronchoalveolární laváž i přes určitá úskalí představuje významnou metodu v diagnostice plicního postižení různé etiologie. Plicní komplikace jsou u imunokompromitovaných nemocných časté a včasná diagnostika a zahájení cílené léčby má pro tyto nemocné zásadní význam. Je to šetrné, opakovatelné a v rukou zkušeného bronchologa bezpečné vyšetření, kterým získáme materiál lépe odrážející patologické procesy v plicním parenchymu než sputum nebo bronchiální výplach. Standardizace provedení BAL, nalezení markerů kvality BAT, korelace výsledků nových senzitivních metod v detekci infekcí a odlišení od kontaminace či kolonizace dýchacích cest by mohly lépe přispět k posunu léčebné strategie z empirické k preemptivní.(1, 2, 4,5, 6)
O autorovi: MUDr. Marcela Tomíšková, prof. MUDr. Jana Skřičková CSc.
Masarykova univerzita, Lékařská fakulta a Fakultní nemocnice Brno, Klinika nemocí plicních a tuberkulózy
e-mail: mtomiskova@fnbrno.cz

