Co je kyselina sírová?
Co se dozvíte v článku
Kyselina sírová neboli E513 je jedna z nejvýznamnějších a nejrozšířenějších anorganických kyselin, kterou lze považovat za základní chemikálii v mnoha průmyslových odvětvích. V čisté formě se vyskytuje jako hustá, bezbarvá a olejovitá kapalina. Má extrémně vysokou afinitu k vodě a její hydratační schopnosti jsou velmi silné. Při kontaktu s vodou dochází k prudké exotermní reakci, což činí manipulaci s kyselinou sírovou velmi nebezpečnou.
Tato látka byla známá již ve středověku, a to pod názvem olej vitriolu. Tento název pochází z latiny a odkazuje na starověký způsob výroby kyseliny sírové, kdy byla získávána zahříváním zeleného vitriolu (síran železnatý) nebo modrého vitriolu (síran měďnatý). Zahřátím těchto látek docházelo k uvolňování plynné kyseliny sírové, která kondenzovala na kapalinu podobnou oleji.
Její význam v chemii narůstal s rozvojem chemického průmyslu, kdy se stala základem pro výrobu mnoha chemikálií a materiálů. Dnes je kyselina sírová nepostradatelnou látkou v chemickém průmyslu a je jedním z indikátorů ekonomické vyspělosti dané země, protože její spotřeba odráží úroveň průmyslové výroby. [1, 2, 3, 4]
Výroba kyseliny sírové
Výroba kyseliny sírové probíhá převážně tzv. kontaktním procesem, který se používá od 19. století a dnes je nejefektivnějším a nejrozšířenějším způsobem výroby této látky. Proces začíná spalováním síry nebo pyritu na oxid siřičitý. Oxid siřičitý se pak dále oxiduje na oxid sírový (SO3) v přítomnosti katalyzátoru, nejčastěji pentoxidu vanadičného. Z oxidu sírového se následně získá kyselina sírová.
Celý proces je navržen tak, aby minimalizoval úniky škodlivých plynů a maximalizoval účinnost produkce. Vedlejší produkty a teplo generované během výroby jsou obvykle recyklovány zpět do procesu, což přispívá k udržitelnosti a ekonomičnosti výroby. Tato technologie umožňuje výrobu kyseliny sírové ve velkých množstvích, což je důležité pro uspokojení globální poptávky. [5, 6, 7]
Vzorec a chemické vlastnosti kyseliny sírové
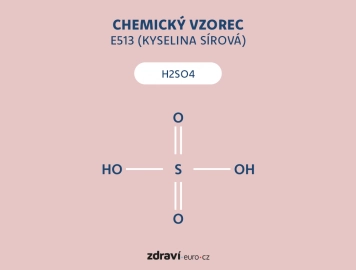
Kyselina sírová má chemický vzorec H2SO4 a jedná se o látku se silnými oxidačními a dehydratačními vlastnostmi. Jako silné oxidační činidlo může reagovat s mnoha kovy a organickými látkami, často za vzniku tepla, plynů nebo vedlejších produktů. Navíc může oxidovat i některé látky, které jsou za normálních podmínek odolné vůči běžným oxidantům.
Kromě toho je také silně hygroskopická, což znamená, že velmi účinně absorbuje vodu z okolního prostředí. Tato vlastnost je využívána v mnoha průmyslových procesech. Rovněž to však znamená, že koncentrovaná kyselina sírová může při kontaktu s organickými materiály (včetně lidské kůže) způsobit těžké popáleniny tím, že okamžitě vysaje vodu z tkání. [8, 9, 10, 11]
Jaké má kyselina sírová použití?
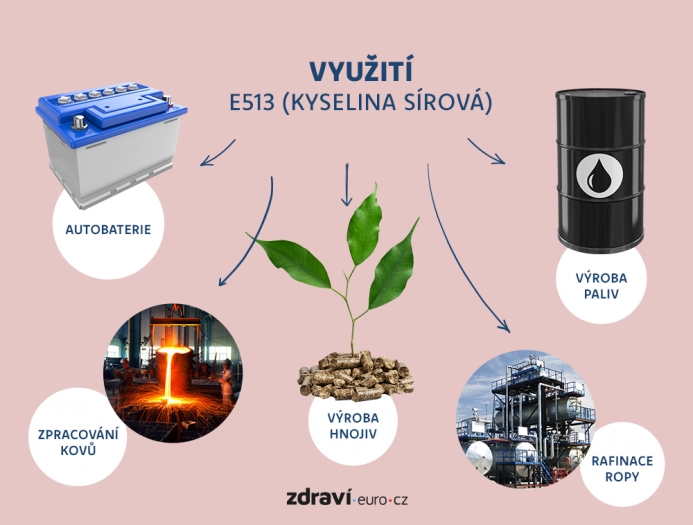
Kyselina sírová patří mezi nejpoužívanější chemikálie v průmyslu, což je dáno její univerzálností a významnými chemickými vlastnostmi, jako je silná kyselost a schopnost dehydratace. Hlavní využití nachází především v chemickém, zemědělském a energetickém sektoru, ale uplatňuje se i v dalších odvětvích, což z ní činí jednu z nejdůležitějších chemikálií moderní doby.
Jedním z největších odběratelů kyseliny sírové je zemědělský průmysl, kde je důležitá pro výrobu hnojiv. Kyselina sírová se používá při produkci superfosfátu. Během tohoto procesu přeměňuje nerozpustné fosfáty na rozpustné fosforečnany, které jsou snadno dostupné pro rostliny, což zvyšuje úrodnost půdy a podporuje růst plodin. Kyselina sírová je rovněž využívána při výrobě síranu amonného, dalšího důležitého hnojiva, které dodává půdě dusík a síru, základní živiny pro rostliny.
V petrochemickém průmyslu hraje kyselina sírová zásadní roli při rafinaci ropy a výrobě paliv a navíc je základní surovinou pro výrobu široké škály chemikálií. Používá se například při výrobě kyseliny fosforečné, která je důležitá nejen pro výrobu hnojiv, ale i v potravinářství, kde slouží jako okyselovadlo a konzervační činidlo.
Dále je kyselina sírová využívána při výrobě kyseliny chlorovodíkové, kyseliny fluorovodíkové a dalších anorganických kyselin. Významná je také její role v syntéze síranů, které se používají v různých aplikacích, od výroby detergentů po ošetření vody.
V metalurgickém průmyslu se kyselina sírová používá při zpracování kovů, zejména při čištění a leptání povrchů kovů. Během tohoto procesu kyselina sírová odstraňuje oxidy a nečistoty z povrchu kovů, jako je železo, ocel nebo měď, což zlepšuje jejich kvalitu a připravuje je na další zpracování, například galvanizaci nebo lakování. V rafinaci mědi a dalších neželezných kovů se kyselina sírová používá k separaci kovů z rud, což je klíčový krok při výrobě čistého kovu.
Další významné využití kyseliny sírové je v energetickém sektoru, konkrétně při výrobě olověných akumulátorů, které jsou hojně využívány v automobilovém průmyslu a pro záložní zdroje energie. V těchto akumulátorech umožňuje kyselina sírová chemickou reakci mezi olověnými deskami a elektrolytem, což vede k ukládání a uvolňování elektrické energie.
Hojně se pak také používá v textilním průmyslu při zpracování vláken, kde slouží například k barvení a úpravám textilií. V papírenském průmyslu je důležitá při výrobě papíru a kartonu, kde se užívá k odstranění nečistot z dřevní buničiny. Tímto způsobem přispívá ke zlepšení kvality finálních produktů a zvyšuje efektivitu výroby.
V neposlední řadě hraje kyselina sírová důležitou roli například i při čištění vody. Užívá se k úpravě pH odpadních vod před jejich vypuštěním do přírodních vodních toků, což je zásadní pro ochranu vodního ekosystému. Kyselina sírová se také používá při srážení nežádoucích látek z odpadních vod, čímž se snižuje obsah škodlivých látek a zlepšuje kvalita vody. [12, 13, 14, 15, 16]
Účinky kyseliny sírové na lidské zdraví
Kyselina sírová je vysoce korozivní a může přivodit vážné zdravotní problémy při kontaktu s tělem. Když přijde do styku s kůží, dochází k chemickým popáleninám, které mohou být velmi bolestivé a způsobit hluboké poškození tkání. Tyto popáleniny se často nehojí snadno a mohou zanechat trvalé jizvy. Při styku s očima je nebezpečí ještě větší, protože kyselina sírová může rychle poškodit oční tkáně, což může vést k trvalému poškození zraku, nebo dokonce k oslepnutí.
Inhalace par kyseliny sírové je další vážné riziko. Při vdechnutí se mohou páry dostat do dýchacích cest, což může způsobit jejich podráždění, bolest v krku, kašel, dušnost a v závažných případech plicní edém, což je život ohrožující stav, kdy dochází k hromadění tekutiny v plicích.
Chronická expozice nízkým koncentracím kyseliny sírové může vést k trvalému poškození dýchacích cest a zvyšuje riziko vzniku chronických onemocnění, jako je bronchitida nebo astma. Dlouhodobý kontakt s malými množstvími kyseliny sírové může také způsobit dermatitidu, což je zánět kůže doprovázený svěděním a vyrážkami.
Extrémně závažné nebezpečí pro lidské zdraví, které může mít fatální následky, pak představuje požití této látky. Kyselina sírová v takovém případě okamžitě reaguje s tkáněmi v ústech, hltanu, jícnu a žaludku, což má za následek těžké chemické popáleniny a hluboké poškození těchto orgánů. Toto poškození může způsobit perforaci stěn žaludku nebo jícnu, což vede k rozsáhlému vnitřnímu krvácení a vážným infekcím. Tyto stavy jsou velmi vážné a vyžadují urgentní lékařský zákrok, včetně chirurgického zákroku.
Poleptala vás někdy kyselina sírová?
Kromě přímého poškození tkání může požití kyseliny sírové způsobit i šokový stav, což je tělesná reakce na rozsáhlé poškození, kdy tělo nedokáže udržet stabilní krevní oběh a krevní tlak, což ohrožuje život pacienta. V takových případech je nezbytná okamžitá lékařská pomoc, aby se minimalizovalo riziko trvalých následků nebo smrti pacienta. [17, 18, 19, 20]
První pomoc
V případě expozice kyselině sírové se musí jednat rychle a efektivně, aby se minimalizovaly její škodlivé účinky. Pokud kyselina přijde do kontaktu s kůží, je třeba postižené místo okamžitě a důkladně opláchnout velkým množstvím vody, oplachovat by se mělo po dobu alespoň 10 až 15 minut. Zároveň je důležité co nejrychleji odstranit kontaminované oblečení, aby se zabránilo dalšímu šíření kyseliny na tělo. V případě zasažení očí je zapotřebí oči ihned začít vyplachovat vodou nebo fyziologickým roztokem, a to po dobu minimálně 15 minut, přičemž oči by měly být co nejvíce otevřené.
V případě požití kyseliny sírové je nutné okamžitě vyhledat lékařskou pomoc. Nikdy by se nemělo vyvolávat zvracení, protože to může způsobit další poškození jícnu a hrdla. Namísto toho by měl postižený vypít malé množství vody nebo mléka, aby se kyselina v žaludku zředila, pokud je stále při vědomí a schopen polykat. Pacient by měl být co nejdříve dopraven do nemocnice, kde může být podrobně vyšetřen a může mu být poskytnuta odpovídající léčba, včetně neutralizace kyseliny a ošetření popálenin.
Ve všech případech je zásadní neprodleně vyhledat lékařskou pomoc, a to i v případě, že se příznaky zdají být mírné, protože následky mohou být závažné a dlouhodobé. Právě rychlost a správnost provedení první pomoci může rozhodnout o závažnosti poškození a výsledné prognóze pro pacienta. [21, 22, 23, 24]
Zdroje: nzip.cz, chemistry.ujep.cz, dcceew.gov.au, nj.gov, assets.publishing.service.gov.uk, ncbi.nlm.nih.gov, chemicalbook.com, sciencedirect.com, essentialchemicalindustry.org, chemeurope.com, testbook.com, britannica.com, krizport.cz, wikiskripta.eu, skoleniprvnipomoci.cz